EL COEFICIENTE DE ABSORCIÓN CONTINUA
10.1
INTRODUCCIÓN
En la Sección 6.8 hemos definido el coeficiente másico de
absorción kn. Por lo
general, suelen definirse dos coeficientes de absorción, uno que da lugar al
espectro continuo, usualmente denotado kn, y otro que sólo
tiene validez en las líneas espectrales y suele denotarse ln. Nuestro
problema consiste ahora en calcular el coeficiente másico de absorción continua
kn , con la mejor
precisión posible. Si, como hemos visto en el capítulo anterior, no es posible
definir un coeficiente de absorción continua independiente de la frecuencia,
habrá entonces que calcular la dependencia explícita con esta variable. Resulta
fácil imaginar que la forma del espectro continuo de una
estrella, estará estrechamente ligada a la dependencia del coeficiente de
absorción con la frecuencia.
10.2
ORIGEN DE LA OPACIDAD CONTINUA : TRANSICIONES LIGADO-LIBRE Y LIBRE-LIBRE
¿ Cuál es el orígen de la
opacidad continua ? Es decir, a qué se debe la absorción continua observada en
los espectros estelares ? En rigor, la absorción continua observada en una
determinada frecuencia en un espectro estelar, resulta de la suma de las
absorciones (verdaderas y aparentes) producidas en esa frecuencia por
determinados procesos físicos, los cuales involucran distintos elementos
químicos en sus respectivos estados de excitación y/o ionización. Como veremos
en este capítulo, las absorciones deben ser corregidas o disminuidas por las
denominadas absorciones negativas o emisiones estimuladas.
Los procesos
físicos de absorción verdadera que
contribuyen a la opacidad continua pueden ser divididos esencialmente en dos
categorías: (1) procesos de absorción ligado-libre
y (2) procesos libre-libre. Los
mecanismos de absorción aparente
incluyen básicamente la dispersión de la radiación producida por electrones
libres (dispersión Thompson) o bien
por sistemas ligados, tales como átomos o moléculas (dispersión Rayleigh).
En un proceso de absorción radiativo ligado-libre (ionización), un átomo absorbe un fotón hn del campo de radiación, cuya energía es
suficientemente grande como para liberar un electrón, quedando en consecuencia
ionizado el átomo. El proceso de absorción en este caso es radiativo porque involucra fotones y es ligado-libre simplemente porque el electrón que estaba ligado al
átomo, se liberó de él. Puesto que las posibles energías hn que pueden ser absorbidas mediante este proceso son infinitas y
varían con continuidad a partir de una energía
umbral (energía mínima necesaria para arrancar un electrón), las
transiciones radiativas ligado-libre de un determinado elemento químico
contribuyen al espectro continuo observado. Precisamente, el espectro de ionizaciones es el espectro
continuo debido a transiciones radiativas ligado-libre. Nótese que los procesos
inversos a las fotoionizaciones corresponden a las transiciones libre-ligado, usualmente llamadas recombinaciones.
Un proceso de absorción libre-libre ocurre cuando una partícula libre (un electrón, por
ejemplo), moviéndose en el campo de un protón - puede ser en general un ión o
un átomo neutro - absorbe un fotón de energía hn y éste desaparece. Como
resultado de la absorción, la partícula libre (electrón) cambia su velocidad
pasando de su órbita hiperbólica original a otra algo más alejada del protón (Figura 10-1). La transición es radiativa porque implica la desaparición
de un fotón. Es además libre-libre
porque el electrón que estaba libre (energía positiva) continúa con energía
positiva. Nuevamente, dado que las posibles energías hn que pueden ser absorbidas mediante este proceso son infinitas y
varían con continuidad, las transiciones radiativas libre-libre de un
determinado elemento químico contribuyen al espectro continuo.

Figura 10-1 : En
un proceso de absorción radiativa libre-libre, un electrón moviéndose en el
campo de un protón absorbe un fotón y cambia su órbita hiperbólica original
hacia otra más alejada del protón.
Cuando se menciona la contribución de los procesos
libre-libre de un determinado elemento químico a la opacidad del continuo, se
hace referencia a la capacidad que tienen los electrones libres de dicho
elemento para absorber energía por procesos libre-libre tales como el
mencionado.
El conocido efecto
Compton no puede considerarse propiamente un ejemplo de proceso de
absorción libre-libre. Ello se debe a que este efecto consiste en la
interacción de un fotón con un electrón en la manera esquematizada en la Figura 10-2. Es decir, incide un fotón
de energía hn sobre el electrón y una parte de la energía
del fotón es absorbida por el electrón, el cual adquiere una cierta velocidad o
la aumenta si es que se encontraba inicialmente en reposo. Como resultado de la
interacción, el fotón inicial hn se transforma en otro hn’ de menor
energía, habiendo el electrón absorbido en el proceso la cantidad DE = h(n
- n’). Dado que el
fotón no desaparece sino que se enrojece, no corresponde hablar propiamente de absorción. Además, para que ocurra una
transición libre-libre no puede haber un electrón libre en el espacio, sino que
el electrón debe estar en el campo de un átomo o ión, es decir, debe tener un
núcleo asociado.

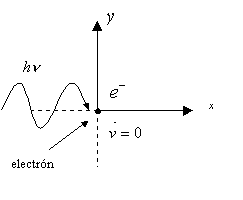
Figura 10-2 : Al
chocar un fotón hn con un electrón en
reposo, el fotón se dispersa en la
dirección del ángulo j, con una frecuencia n’ menor que la original, en tanto que el electrón adquiere una
velocidad v y se dispersa en la dirección q.
Una transición ligado-libre puede ocurrir no sólo
radiativamente involucrando fotones, sino también colisionalmente. En este
último caso no desaparece ningún fotón del campo radiante. En efecto, un proceso de absorción colisional ligado-libre ocurre cuando una partícula
libre (electrón, por ejemplo), moviéndose con una velocidad vi elevada, colisiona con un átomo o ión. Si dicha partícula tiene
una elevada energía cinética en virtud de su alta velocidad, al colisionar con
el átomo o ión puede cederle parte de su energía cinética, desviarse su
trayectoria y continuar con una velocidad final vf, siendo vf
< vi. Si la energía DE = ![]() cedida por la
partícula al átomo o ión es suficientemente grande como para producir el
desprendimiento de un electrón, entonces el átomo o ión absorbió
colisionalmente la energía DE. El proceso es
ligado-libre debido a que el electrón
que estaba ligado al átomo o ión quedó liberado, esto es, su energía pasó de un
valor negativo a otro positivo. Sin embargo, en virtud de que las transiciones
colisionales ligado-libre de un determinado elemento químico no implican la
desaparición de fotones, estos procesos no contribuyen al espectro continuo.
cedida por la
partícula al átomo o ión es suficientemente grande como para producir el
desprendimiento de un electrón, entonces el átomo o ión absorbió
colisionalmente la energía DE. El proceso es
ligado-libre debido a que el electrón
que estaba ligado al átomo o ión quedó liberado, esto es, su energía pasó de un
valor negativo a otro positivo. Sin embargo, en virtud de que las transiciones
colisionales ligado-libre de un determinado elemento químico no implican la
desaparición de fotones, estos procesos no contribuyen al espectro continuo.
También pueden ocurrir procesos libre-libre de tipo colisional, los cuales tampoco
involucran fotones. Como resultado de un proceso de este tipo, una partícula
puede ganar (absorber) o perder energía cinética. Sin embargo, dado que este
proceso no implica la desaparición de fotón alguno, no contribuye al espectro
continuo. Un ejemplo de absorción colisional libre-libre lo constituye la
colisión de un electrón de velocidad vi con otra partícula cualquiera (átomo, ión,
electrón, etc). Si como resultado de la colisión el electrón adquiere una
velocidad vf mayor que la
velocidad vi que traía
inicialmente, significa que la partícula entregó parte de su energía cinética
al electrón y éste la absorbió. Colisión no significa literalmente choque,
aunque efectivamente éste puede ocurrir, sino más bien interacción debido a un
pasaje cercano.
Cuando un
electrón, después de colisionar con otra partícula (un protón, por ejemplo),
pierde parte de su energía siendo la misma emitida,
se dice que ocurrió también una transición libre-libre. La energía emitida en
este caso se denomina radiación de frenado
(bremsstrahlung) debido a que el electrón se frena en parte al emitir.
Finalmente, debemos mencionar que existen también las transiciones ligado-ligado, las cuales
contribuyen a la formación de las líneas espectrales y no al espectro continuo.
Si bien la absorción en las líneas no se incluye en el coeficiente kn, cuando en
ciertas regiones del espectro muchas líneas se superponen (blends), éstas se
comportan como si contribuyeran a la absorción continua. La disminución del
continuo debido a la superposición de líneas en una determinada región del
espectro se conoce como efecto blanketing
o efecto frazada.
10.3
COMPOSICIÓN QUÍMICA EN LAS FOTOSFERAS ESTELARES
Para determinar el coeficiente de absorción continua
total de una fotosfera estelar, es necesario conocer al menos en forma
aproximada la composición química de la misma. Esto es así simplemente porque
la capacidad de absorción varía para cada elemento químico. El coeficiente de
absorción total determinado por la composición química de toda la fotosfera,
dependerá marcadamente de las cantidades relativas de los elementos químicos
presentes en la misma.
Las observaciones demuestran que la composición química
de las fotosferas estelares es aproximadamente similar en la gran mayoría de
las estrellas. En efecto, suponiendo la composición química constante y
admitiendo que sólo cambia la temperatura y la presión electrónica, es posible
explicar en forma completa la secuencia espectral de Harvard, incluyendo las
distintas clases de luminosidad .
Dado que en cada fotosfera la densidad suele ser por lo
general diferente, es razonable hablar de composiciones químicas relativas o de porcentajes presentes de cada elemento químico. Esta composición
química relativa puede definirse tomando la cantidad de algún elemento como
unidad y luego refiriendo los otros elementos a éste, o bien considerando el
conjunto de todos los elementos como el 100% y luego indicando el porcentaje de
cada elemento presente en la fotosfera. A su vez, la cantidad relativa de cada elemento
puede expresarse por número de átomos o por masa. En el primer caso, si en un
centímetro cúbico de la fotosfera de una estrella hay n1 átomos del elemento 1, n2 átomos del elemento 2, etc, y tomamos como unidad la
cantidad de átomos del elemento 1, entonces la cantidad relativa del elemento j (por número de átomos) será :
![]() (10.1)
(10.1)
Por su parte, si la masa de un átomo del elemento 1 es m1, la masa de un átomo del
elemento 2 es m2, etc., y
tomamos como unidad la masa total de los átomos del elemento 1, la cantidad
relativa del elemento j (por masa)
será :
![]() (10.2)
(10.2)
Análogamente, la cantidad relativa del elemento j expresada como un porcentaje respecto
del total y por número de átomos será :
![]() , (10.3)
, (10.3)
en tanto que la cantidad
relativa del elemento j expresada
como un porcentaje respecto del total y por masa será :
![]() (10.4)
(10.4)
Si bien las cantidades relativas de los diversos
elementos químicos varían en función de la profundidad óptica en cada fotosfera
estelar, numerosas observaciones sugieren que esta variación no es
significativa, motivo por el cual aceptaremos en adelante que al especificar la
composición química relativa, en cualquiera de las formas antes mencionadas,
los coeficientes respectivos (![]() o
o ![]() ) son los mismos en toda la fotosfera estelar. Numerosas
observaciones demuestran además que el hidrógeno es el elemento preponderante
no sólo en las estrellas, sino también en las nebulosas planetarias y en
general en el medio interestelar. En particular, por ser este elemento el más
abundante en las fotosferas estelares, su contribución al coeficiente de
absorción continua será fundamental.
) son los mismos en toda la fotosfera estelar. Numerosas
observaciones demuestran además que el hidrógeno es el elemento preponderante
no sólo en las estrellas, sino también en las nebulosas planetarias y en
general en el medio interestelar. En particular, por ser este elemento el más
abundante en las fotosferas estelares, su contribución al coeficiente de
absorción continua será fundamental.
10.4
UNIDADES DEL COEFICIENTE DE ABSORCIÓN CONTINUA
Si bien mantendremos la notación kn previamente introducida para el coeficiente
másico de absorción continua, expresado en cm2
por gramo de materia estelar en el
sistema c.g.s., denotaremos en
adelante con la letra a al coeficiente de absorción
continua expresado en cm2 por absorbedor. En consecuencia, cada
elemento químico estará caracterizado por un determinado valor de a. En este
contexto, dos átomos de un mismo elemento químico en distintos estados de
excitación, por ejemplo, serán considerados dos absorbedores diferentes, cada
uno de los cuales estará caracterizado por un determinado valor del coeficiente
a. Nótese que este
coeficiente a dependerá en general de la
longitud de onda l o frecuencia n que se considere. Sin embargo, dado que al o an no representan una función de distribución
en el mismo sentido que ![]() o
o ![]() , por ejemplo, no
usaremos en adelante el subíndice. Esto significa que una vez fijada l o n, el
coeficiente
, por ejemplo, no
usaremos en adelante el subíndice. Esto significa que una vez fijada l o n, el
coeficiente ![]() será simplemente un número.
será simplemente un número.
Llamaremos además k al coeficiente de absorción continua de un
elemento químico, cuando el mismo esté expresado en cm2 por átomo de
hidrógeno neutro. Al igual que a, el coeficiente k presentará una dependencia con la longitud de onda, pero no
representa una función de distribución. Finalmente, el producto ![]() es el coeficiente de
absorción continua por unidad de longitud.
es el coeficiente de
absorción continua por unidad de longitud.
10.5 COEFICIENTE DE ABSORCIÓN CONTINUA EN FUNCIÓN DE LOS COEFICIENTES DE EINSTEIN
En la Sección 3.15 hemos descripto tres
clases de transiciones radiativas posibles denominadas, respectivamente,
emisión espontánea, absorción verdadera y emisión estimulada. La frecuencia con
que se producen estos diferentes procesos depende de la población de los
niveles de energía correspondientes, de las denominadas probabilidades de
transición de dichos niveles y, en los casos de la absorción y la emisión
estimulada, de la intensidad del campo de radiación.
Consideremos ahora sólo dos niveles
de energía i y j de un átomo y sea E = hn la diferencia de energía entre los mismos,
siendo i el nivel superior y j el inferior. Supongamos que el átomo
en cuestión se encuentra en un campo de radiación isótropo y veamos cuáles son
las transiciones posibles entre los dos niveles considerados.
La probabilidad de que el átomo emita espontáneamente, sin influencia del campo, su energía cuántica hn en un tiempo dt y que ese fotón siga su camino dentro de un ángulo sólido dw es :
![]() , (10.5)
, (10.5)
en la cual ![]() se denomina coeficiente de Einstein de emisión
espontánea o probabilidad de transición espontánea. Este coeficiente
expresa entonces la probabilidad de que el átomo emita espontáneamente su
energía hn en el tiempo dt y
dentro del ángulo sólido dw. El
coeficiente
se denomina coeficiente de Einstein de emisión
espontánea o probabilidad de transición espontánea. Este coeficiente
expresa entonces la probabilidad de que el átomo emita espontáneamente su
energía hn en el tiempo dt y
dentro del ángulo sólido dw. El
coeficiente ![]() depende de los dos
niveles involucrados, de modo que para cada par de niveles de energía de un
átomo
depende de los dos
niveles involucrados, de modo que para cada par de niveles de energía de un
átomo ![]() es un número, una constante. Si
es un número, una constante. Si ![]() átomos por unidad de
volumen se encuentran en el nivel i,
la contribución de la emisión espontánea al coeficiente de emisión total por
unidad de volumen
átomos por unidad de
volumen se encuentran en el nivel i,
la contribución de la emisión espontánea al coeficiente de emisión total por
unidad de volumen ![]() es :
es :
![]() (10.6)
(10.6)
Si el átomo se encuentra en un campo radiante ![]() isótropo, el cual
dispone de fotones con energía hn, dicho campo
puede estimular o inducir al átomo en el nivel i a emitir un fotón hn. Este proceso
de emisión estimulada o inducida se conoce también como absorción negativa, ya que representa el proceso inverso de la
absorción de un fotón del campo. En la emisión estimulada o absorción negativa,
el fotón es emitido en la misma dirección y fase que el fotón incidente. Es
decir, los fotones en este caso no son emitidos en direcciones al azar como ocurre
en el proceso de emisión espontánea.
isótropo, el cual
dispone de fotones con energía hn, dicho campo
puede estimular o inducir al átomo en el nivel i a emitir un fotón hn. Este proceso
de emisión estimulada o inducida se conoce también como absorción negativa, ya que representa el proceso inverso de la
absorción de un fotón del campo. En la emisión estimulada o absorción negativa,
el fotón es emitido en la misma dirección y fase que el fotón incidente. Es
decir, los fotones en este caso no son emitidos en direcciones al azar como ocurre
en el proceso de emisión espontánea.
La probabilidad de que un átomo sea inducido por el campo
a emitir su energía hn en un tiempo dt y dentro de un ángulo sólido dw es :
![]() , (10.7)
, (10.7)
en la cual ![]() se denomina coeficiente de Einstein de emisión
estimulada. Dado que la emisión estimulada representa como hemos dicho una
absorción negativa, de acuerdo a (6.45) la cantidad de energía absorbida
negativamente por unidad de longitud es :
se denomina coeficiente de Einstein de emisión
estimulada. Dado que la emisión estimulada representa como hemos dicho una
absorción negativa, de acuerdo a (6.45) la cantidad de energía absorbida
negativamente por unidad de longitud es :
![]() (10.8)
(10.8)
Finalmente, la probabilidad de que sea absorbido
realmente un cuanto de energía hn del campo y que el átomo se excite del
nivel j al i, en un tiempo dt y dentro de un ángulo sólido dw, es :
![]() , (10.9)
, (10.9)
en la cual ![]() es el coeficiente de Einstein de absorción
verdadera. Teniendo en cuenta la expresión (6.45), la radiación absorbida
verdaderamente por unidad de longitud, en la unidad de tiempo, será :
es el coeficiente de Einstein de absorción
verdadera. Teniendo en cuenta la expresión (6.45), la radiación absorbida
verdaderamente por unidad de longitud, en la unidad de tiempo, será :
![]() , (10.10)
, (10.10)
siendo ![]() el número de átomos
en el nivel j por unidad de volumen.
el número de átomos
en el nivel j por unidad de volumen.
En consecuencia, la radiación total absorbida por unidad
de longitud de camino del rayo de intensidad ![]() es :
es :
![]() , (10.11)
, (10.11)
O bien :
![]() , (10.12)
, (10.12)
en la cual kn queda expresado en función de los coeficientes
de Einstein.
10.6
FACTOR DE EMISIONES ESTIMULADAS
De
acuerdo a lo expresado en la sección precedente, el número de emisiones
espontáneas del nivel i al j por unidad de tiempo, unidad de ángulo
sólido y unidad de volumen es ![]() , en tanto que
, en tanto que ![]() y
y ![]() representan
respectivamente los números de absorciones negativas y absorciones verdaderas,
por segundo, unidad de ángulo sólido y unidad de volumen. Si suponemos que
estamos en condiciones de equilibrio
térmico, las poblaciones relativas de los dos niveles de energía
considerados verifican la ley de Boltzmann :
representan
respectivamente los números de absorciones negativas y absorciones verdaderas,
por segundo, unidad de ángulo sólido y unidad de volumen. Si suponemos que
estamos en condiciones de equilibrio
térmico, las poblaciones relativas de los dos niveles de energía
considerados verifican la ley de Boltzmann :
![]() , (10.13)
, (10.13)
en la cual T es la temperatura, ![]() y
y ![]() los pesos
estadísticos de los respectivos niveles y hn la diferencia de energía
entre los 2 niveles. En equilibrio térmico existe balance detallado de energía,
de manera que el número total de emisiones debe igualar el número de
absorciones. Esto es :
los pesos
estadísticos de los respectivos niveles y hn la diferencia de energía
entre los 2 niveles. En equilibrio térmico existe balance detallado de energía,
de manera que el número total de emisiones debe igualar el número de
absorciones. Esto es :
![]() ,
(10.14)
,
(10.14)
en la cual hemos usado ![]() en lugar de
en lugar de ![]() porque en condiciones
de equilibrio térmico la intensidad está dada por la función de Planck. De
(10.13) y (10.14) resulta :
porque en condiciones
de equilibrio térmico la intensidad está dada por la función de Planck. De
(10.13) y (10.14) resulta :
![]() ,
,
o bien, multiplicando por ![]() y ordenando términos, se tiene :
y ordenando términos, se tiene :
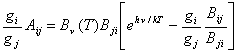 (10.15)
(10.15)
Reemplazando en (10.15) la función de Planck dada en (2.8) se obtiene :
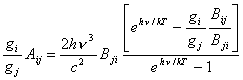 (10.16)
(10.16)
Dado que los 3 coeficientes de Einstein que aparecen en
esta última expresion no pueden depender de la temperatura T, ya que son constantes para un determinado átomo, deben entonces
verificarse las siguientes igualdades :
![]() (10.17)
(10.17)
y
![]() (10.18)
(10.18)
Nótese que si uno de los coeficientes de Einstein se
conoce, pueden derivarse los otros dos de las expresiones anteriores. Por otra
parte, si bien las relaciones entre los coeficientes de Einstein han sido
derivadas considerando condiciones de equilibrio térmico, es importante
destacar que las expresiones (10.17) y (10.18) se mantienen en todas las
condiciones.
El problema que nos planteamos en este capítulo es
obtener el coeficiente másico de absorción continua kn y hemos visto
en la sección precedente que las emisiones estimuladas o absorciones negativas
tienen su influencia en la absorción total. Si se escribe (10.12) de la
siguiente manera :
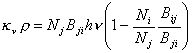 , (10.19)
, (10.19)
y se tienen en cuenta
(10.13) y (10.17) resulta :
![]() (10.20)
(10.20)
El término entre paréntesis en la expresión anterior
tiene en cuenta las emisiones estimuladas, ya que ![]() es pura absorción. En
rigor, lo que representa absorción verdadera es el producto
es pura absorción. En
rigor, lo que representa absorción verdadera es el producto ![]() . Sin embargo, si se multiplica miembro a miembro la
expresión (10.20) por
. Sin embargo, si se multiplica miembro a miembro la
expresión (10.20) por ![]() , el factor entre paréntesis representa las emisiones
estimuladas. En otras palabras, la absorción verdadera producida es disminuida
en un factor
, el factor entre paréntesis representa las emisiones
estimuladas. En otras palabras, la absorción verdadera producida es disminuida
en un factor ![]() , conocido como factor
de emisiones estimuladas, el cual aumenta a medida que aumenta la
temperatura y a medida que disminuye la frecuencia considerada. Para una
estrella A0V, por ejemplo, cuya temperatura superficial es del orden de 10.000 oK,
la disminución de la absorción debida al factor de emisiones estimuladas supera
el 20% en la región del continuo de Paschen y más allá de 10.000 Å sobrepasa el
30%.
, conocido como factor
de emisiones estimuladas, el cual aumenta a medida que aumenta la
temperatura y a medida que disminuye la frecuencia considerada. Para una
estrella A0V, por ejemplo, cuya temperatura superficial es del orden de 10.000 oK,
la disminución de la absorción debida al factor de emisiones estimuladas supera
el 20% en la región del continuo de Paschen y más allá de 10.000 Å sobrepasa el
30%.
Debe tenerse en cuenta que el factor de emisiones
estimuladas ha sido derivado para el caso de una transición ligado-ligado.
Milne (1924), sin embargo, ha mostrado que dicho factor se mantiene para el
caso de una transición libre-libre.
10.7 CONTRIBUCIÓN DEL HIDRÓGENO NEUTRO A LA OPACIDAD
CONTINUA
10.7.1
Procesos ligado-libre
Cada elemento químico contribuye en forma particular al
coeficiente de absorción continua. Dado que el hidrógeno es el elemento más
abundante en las fotosferas de las estrellas normales, comenzaremos examinando
la contribución a la opacidad continua de este elemento. Los procesos que
aportan al coeficiente de absorción continua son las transiciones ligado-libre
y libre-libre del mencionado elemento.
Comencemos por considerar las transiciones radiativas ligado-libre del hidrógeno neutro. Para que
dichas transiciones puedan ocurrir es necesario proporcionar al átomo una
energía hn
suficientemente grande como para liberarlo de su único electrón. Si R = ![]() es la constante de
Rydberg, de (3.17) se desprende que la energía del nivel discreto con número
cuántico principal n, ligado al átomo
de hidrógeno (Z = 1), es
es la constante de
Rydberg, de (3.17) se desprende que la energía del nivel discreto con número
cuántico principal n, ligado al átomo
de hidrógeno (Z = 1), es ![]() . Si un electrón en ese nivel absorbe un fotón de energía hn y se libera del átomo con una velocidad v, resulta :
. Si un electrón en ese nivel absorbe un fotón de energía hn y se libera del átomo con una velocidad v, resulta :
![]() , (10.21)
, (10.21)
en la cual el primer miembro
es la energía cinética del electrón y R
= 1.0968x105 cm-1
para el átomo de hidrógeno.
En la Sección 3.4 vimos que el potencial de ionización
del hidrógeno neutro es 13.6 eV. Ésta
es la energía mínima necesaria para arrancarle al átomo su único electrón desde
el nivel fundamental. En otras palabras, el potencial de ionización del
hidrógeno neutro es la energía ![]() que es necesario
suministrar al átomo para arrancarle su único electrón desde el nivel
fundamental y de manera tal que dicho electrón se libere con energía cinética
nula. De (10.21) se deduce que I = hRc,
cantidad ésta que para el átomo de H equivale a 13.6 eV. Por consiguiente, sólo aquellos fotones con energías mayores
que 13.6 eV estarán en condiciones de
producir transiciones radiativas ligado-libre desde el nivel fundamental del
átomo de H. Dado que la longitud de onda asociada a un fotón con esta energía
es lL = hc/13.6 eV = 912 Å, todos los fotones con
energías mayores que 13.6 eV, o bien
con longitudes de onda asociadas menores que 912 Å, estarán en condiciones de
fotoionizar al hidrógeno desde el nivel fundamental. Esta lL = 912 Å
representa el límite de la serie de Lyman.
que es necesario
suministrar al átomo para arrancarle su único electrón desde el nivel
fundamental y de manera tal que dicho electrón se libere con energía cinética
nula. De (10.21) se deduce que I = hRc,
cantidad ésta que para el átomo de H equivale a 13.6 eV. Por consiguiente, sólo aquellos fotones con energías mayores
que 13.6 eV estarán en condiciones de
producir transiciones radiativas ligado-libre desde el nivel fundamental del
átomo de H. Dado que la longitud de onda asociada a un fotón con esta energía
es lL = hc/13.6 eV = 912 Å, todos los fotones con
energías mayores que 13.6 eV, o bien
con longitudes de onda asociadas menores que 912 Å, estarán en condiciones de
fotoionizar al hidrógeno desde el nivel fundamental. Esta lL = 912 Å
representa el límite de la serie de Lyman.
De (10.21) se desprende además que para ionizar el átomo
de H desde el nivel n = 2 se requiere una energía hn = I/4 = 3.40 eV. La longitud de onda asociada a esta energía es ahora lB = hc/3.40 eV = 3647 Å (límite
de la serie de Balmer), de manera que todos los fotones con l £ lB tendrán energías
suficientes como para producir transiciones radiativas ligado-libre del átomo
de H neutro desde el segundo nivel (n = 2)
y asi sucesivamente para las diferentes series espectrales. Los límites de las
series de Paschen, Brackett y Pfund corresponden a las longitudes de onda 8206
Å, 14588 Å y 22790 Å, respectivamente.
Nuestro problema consiste en obtener una expresión del
coeficiente a en cm2 por absorbedor,
para el H neutro. Kramers (1923) consideró un átomo hidrogénico con un electrón
moviéndose en el campo de la carga Ze,
en una órbita cuyo número cuántico principal es n. Haciendo uso de la Física Clásica y para el caso Z = 1, el mencionado autor obtuvo una
expresión para el coeficiente ![]() . Gaunt (1930) modificó levemente la derivación de Kramers
usando la Mecánica Cuántica y obtuvo :
. Gaunt (1930) modificó levemente la derivación de Kramers
usando la Mecánica Cuántica y obtuvo :
![]() , (10.22)
, (10.22)
en la cual e = 4.803x10-10 u.e. es la carga del electrón y ![]() un factor de
corrección, conocido como factor de Gaunt
para las transiciones ligado-libre, el cual hace coincidir la expresión de
Kramers obtenida a partir de la Física Clásica, con los resultados rigurosos
obtenidos a partir de la Mecánica Cuántica. La (10.22) se conoce como fórmula de Kramers-Gaunt.
un factor de
corrección, conocido como factor de Gaunt
para las transiciones ligado-libre, el cual hace coincidir la expresión de
Kramers obtenida a partir de la Física Clásica, con los resultados rigurosos
obtenidos a partir de la Mecánica Cuántica. La (10.22) se conoce como fórmula de Kramers-Gaunt.
En términos de la longitud de onda la expresión anterior
puede escribirse como :
![]() , (10.23)
, (10.23)
o bien en forma simplificada
:
![]() , (10.24)
, (10.24)
siendo ![]() 1.044x10-26 y estando l expresada en angstroms.
1.044x10-26 y estando l expresada en angstroms.
El factor de Gaunt ![]() depende básicamente
de n y de l, en general difiere
poco de la unidad y, de acuerdo a Menzel y Pekeris (1935), puede calcularse de
la expresión :
depende básicamente
de n y de l, en general difiere
poco de la unidad y, de acuerdo a Menzel y Pekeris (1935), puede calcularse de
la expresión :
![]() (10.25)
(10.25)
Nótese de (10.24) que, dentro de cada banda de absorción
(fijado n), el coeficiente an aumenta proporcionalmente
con la tercera potencia de la longitud de onda. Asimismo, para una determinada
longitud de onda, el coeficiente de absorción decrece proporcionalmente a 1/n5. Esto significa que el
coeficiente de absorción de un átomo de H altamente excitado es
considerablemente menor que el de otro levemente excitado. Como el número de
órbitas en el átomo de H es infinito, el número de las bandas de absorción
también es infinito y cada una de ellas contribuirá a la absorción en una
determinada longitud de onda. Las bandas con n = 1, 2, 3, ..., ¥ corresponden a
la fotoionización del átomo de H desde los niveles 1, 2, 3, ..., ¥.
En las frecuencias correspondientes a los límites de
ionización, donde la energía cinética del electrón liberado se anula, la
ecuación (10.21) implica :
![]() , (10.26)
, (10.26)
en la cual ![]() representa la
frecuencia correspondiente al límite de ionización. Dado que
representa la
frecuencia correspondiente al límite de ionización. Dado que ![]() , de (10.24) y (10.26) resulta :
, de (10.24) y (10.26) resulta :
![]() , (10.27)
, (10.27)
en la cual ![]() representa el valor
del coeficiente
representa el valor
del coeficiente ![]() correspondiente al
límite de ionización. La (10.27) muestra que
correspondiente al
límite de ionización. La (10.27) muestra que ![]() aumenta
proporcionalmente con n.
aumenta
proporcionalmente con n.
La Figura 10-3
ilustra la variación del coeficiente ![]() en términos de la
longitud de onda. Las unidades se han elegido de tal manera que
en términos de la
longitud de onda. Las unidades se han elegido de tal manera que ![]() = 1 en l = 100 Å y n = 1. Hay pues una curva para cada n y a su vez cada una de estas curvas
aumenta con el cubo de la longitud de onda según expresa (10.24). Además, las
ordenadas correspondientes a los extremos de cada curva aumentan en forma
proporcional a n según indica
(10.27). Sólo se ilustran en la figura las curvas correspondientes a los
primeros 4 niveles y parte del coeficiente de absorción correspondiente a n = 5. La influencia de los factores de
Gaunt no ha sido considerada en la figura. Si se desea conocer el coeficiente
de absorción del H neutro en una determinada longitud de onda, 6000 Å por
ejemplo, deben sumarse las contribuciones correspondientes a n = 1, n = 2, n = 3, etc. En
este caso particular, sin embargo, la contribución n = 6 y restantes resultan prácticamente despreciables, en tanto
que las correspondientes a n = 1 y n = 2 son nulas.
= 1 en l = 100 Å y n = 1. Hay pues una curva para cada n y a su vez cada una de estas curvas
aumenta con el cubo de la longitud de onda según expresa (10.24). Además, las
ordenadas correspondientes a los extremos de cada curva aumentan en forma
proporcional a n según indica
(10.27). Sólo se ilustran en la figura las curvas correspondientes a los
primeros 4 niveles y parte del coeficiente de absorción correspondiente a n = 5. La influencia de los factores de
Gaunt no ha sido considerada en la figura. Si se desea conocer el coeficiente
de absorción del H neutro en una determinada longitud de onda, 6000 Å por
ejemplo, deben sumarse las contribuciones correspondientes a n = 1, n = 2, n = 3, etc. En
este caso particular, sin embargo, la contribución n = 6 y restantes resultan prácticamente despreciables, en tanto
que las correspondientes a n = 1 y n = 2 son nulas.
Hemos pues obtenido ![]() , coeficiente de absorción continua del átomo de H neutro en cm2 por absorbedor, debido solamente a las transiciones ligado-libre de
este elemento. Nuestro propósito, sin embargo, es obtener el coeficiente másico
de absorción kn en cm2 por gramo de materia estelar, para lo cual será necesario calcular
primero
, coeficiente de absorción continua del átomo de H neutro en cm2 por absorbedor, debido solamente a las transiciones ligado-libre de
este elemento. Nuestro propósito, sin embargo, es obtener el coeficiente másico
de absorción kn en cm2 por gramo de materia estelar, para lo cual será necesario calcular
primero ![]() , el coeficiente de absorción continua del H expresado en cm2 por átomo de H neutro. En este contexto, átomos de H neutro con
diferentes estados de excitación son obsorbedores diferentes. Para obtener el
coeficiente
, el coeficiente de absorción continua del H expresado en cm2 por átomo de H neutro. En este contexto, átomos de H neutro con
diferentes estados de excitación son obsorbedores diferentes. Para obtener el
coeficiente ![]() debemos sumar sobre n los productos de
debemos sumar sobre n los productos de ![]() por la fracción,
respecto del total de átomos de H neutro, de absorbedores de cada nivel. Es
decir :
por la fracción,
respecto del total de átomos de H neutro, de absorbedores de cada nivel. Es
decir :
![]() , (10.28)
, (10.28)
en la cual ![]() es el número de absorbedores
(átomos de H neutro) en el nivel n
por unidad de volumen, N el número
total de átomos de H neutro por unidad de volumen y n0 representa el nivel más bajo a partir del cual
comienzan las contribuciones al coeficiente
es el número de absorbedores
(átomos de H neutro) en el nivel n
por unidad de volumen, N el número
total de átomos de H neutro por unidad de volumen y n0 representa el nivel más bajo a partir del cual
comienzan las contribuciones al coeficiente ![]() . Para l = 9000 Å, por ejemplo, n0 = 4 (Figura 10-3),
ya que para esa longitud de onda no hay contribución para los tres primeros
valores de n.
. Para l = 9000 Å, por ejemplo, n0 = 4 (Figura 10-3),
ya que para esa longitud de onda no hay contribución para los tres primeros
valores de n.

3000 2000 1000 0
![]()
0 2 4 6
8 10 12 14
16 18
Figura 10-3 :
Coeficiente de absorción correspondiente a las transiciones ligado-libre
del átomo de hidrógeno.
La fracción ![]() puede obtenerse de la
ley de Boltzmann (4.7) aplicada al átomo de H :
puede obtenerse de la
ley de Boltzmann (4.7) aplicada al átomo de H :
![]() , (10.29)
, (10.29)
![]()
en la
cual gn es el peso
estadístico del nivel n, ![]() la función de
partición del átomo de H neutro y
la función de
partición del átomo de H neutro y ![]() el potencial de
excitación del nivel n. Para el átomo
de H es
el potencial de
excitación del nivel n. Para el átomo
de H es ![]() y
y![]() = 2, en tanto que el potencial de excitación es, por
definición,
= 2, en tanto que el potencial de excitación es, por
definición, ![]() . Dado que
. Dado que ![]() y además
y además ![]() , resulta :
, resulta :
![]() (10.30)
(10.30)
Luego, de (10.24), (10.28) y (10.29) se obtiene para ![]() la expresión :
la expresión :
![]() (10.31)
(10.31)
De la Figura 10-3
se desprende que para una determinada longitud de onda, la principal
contribución al coeficiente ![]() está dada por los
tres primeros términos. Unsöld (1955) introdujo una importante simplificación
al demostrar que la pequeña contribución producida por los niveles más elevados
puede reemplazarse por la siguiente integral :
está dada por los
tres primeros términos. Unsöld (1955) introdujo una importante simplificación
al demostrar que la pequeña contribución producida por los niveles más elevados
puede reemplazarse por la siguiente integral :
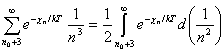 , (10.32)
, (10.32)
lo que resulta evidente si
se tiene en cuenta que ![]() . Unsöld supuso además que
. Unsöld supuso además que ![]() = 1 para
= 1 para ![]() , lo que puede considerarse razonable ya que la integral de
Unsöld es despreciable frente a los tres primeros términos no incluidos en
dicha integral . A su vez, de (10.30) es :
, lo que puede considerarse razonable ya que la integral de
Unsöld es despreciable frente a los tres primeros términos no incluidos en
dicha integral . A su vez, de (10.30) es :
![]() , (10.33)
, (10.33)
y en consecuencia la
integral de Unsöld puede escribirse en términos de la variable ![]() de la siguiente
manera :
de la siguiente
manera :
 , (10.34)
, (10.34)
en la cual ![]() es el potencial de
excitación del nivel
es el potencial de
excitación del nivel ![]() dado por :
dado por :
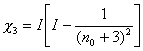 (10.35)
(10.35)
Resolviendo la integral de (10.34) se obtiene :
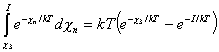 (10.36)
(10.36)
De las expresiones (10.31), (10.34) y (10.36), con la
suposición de que ![]() = 1 para
= 1 para ![]() , resulta :
, resulta :
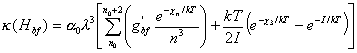 (10.37)
(10.37)
La (10.37) muestra la dependencia del coeficiente ![]() no sólo con la
longitud de onda y el nivel n, sino
también con la temperatura T y los potenciales de ionización y excitación
del átomo de H. En ocasiones, en lugar de la temperatura suele usarse el
parámetro
no sólo con la
longitud de onda y el nivel n, sino
también con la temperatura T y los potenciales de ionización y excitación
del átomo de H. En ocasiones, en lugar de la temperatura suele usarse el
parámetro ![]() . Si la constante de Boltzmann k se expresa en electrón-volts y la temperatura T en grados Kelvin, el parámetro Q puede escribirse como :
. Si la constante de Boltzmann k se expresa en electrón-volts y la temperatura T en grados Kelvin, el parámetro Q puede escribirse como :
![]() , (10.38)
, (10.38)
por lo que es válida la
igualdad : ![]() (10.39)
(10.39)
La (10.39) da lugar a las siguientes igualdades : ![]()
![]() y
y ![]() , las cuales permiten expresar finalmente el coeficiente
, las cuales permiten expresar finalmente el coeficiente ![]() en términos de la variable Q de la siguiente manera :
en términos de la variable Q de la siguiente manera : ![]()
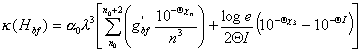 , (10.40)
, (10.40)
en la cual loge = 0.43429 y a0 = 1.044x10-26.
Nótese que el coeficiente ![]() graficado en la Figura 10-3 tiene unidades de cm2 por absorbedor. Si se quisiera comparar esta figura con las
observaciones, el valor de
graficado en la Figura 10-3 tiene unidades de cm2 por absorbedor. Si se quisiera comparar esta figura con las
observaciones, el valor de ![]() debería multiplicarse primero por el número de absorbedores
correspondientes a cada nivel n,
sumarse luego estos productos y finalmente invertir el sentido del crecimiento
del coeficiente
debería multiplicarse primero por el número de absorbedores
correspondientes a cada nivel n,
sumarse luego estos productos y finalmente invertir el sentido del crecimiento
del coeficiente ![]() . Es interesante destacar que, como resultado de todo este
proceso, la variación del coeficiente
. Es interesante destacar que, como resultado de todo este
proceso, la variación del coeficiente ![]() con la longitud de
onda, reproduce bastante bien la distribución observada usualmente en la región
visual e infrarroja cercana del espectro.
con la longitud de
onda, reproduce bastante bien la distribución observada usualmente en la región
visual e infrarroja cercana del espectro.
10.7.2 Procesos libre-libre
Procederemos ahora a examinar la contribución de los procesos libre-libre del H a la
absorción continua. Si bien en la región visible del espectro, la contribución
de los procesos libre-libre del H es mucho menor que la correspondiente a los
procesos ligado-libre, en el infrarrojo ocurre precisamente lo contrario.
Aunque pueden ocurrir interacciones libre-libre entre electrones y electrones,
por lo general es más probable la interacción entre electrones y protones. Una
transición radiativa libre-libre ocurre cuando un electrón libre moviéndose en
el campo de un protón absorbe un fotón y éste desaparece. Como consecuencia de
esta interacción, la energía del electrón aumenta en la energía del fotón. La
capacidad de absorber del electrón libre depende de su energía total ![]() , o bien de su velocidad v. Esto es así por analogía a lo que ocurre en el caso del átomo de
H neutro. En efecto, en este último caso y de acuerdo a la expresión (10.24),
el coeficiente de absorción an en cm2
por absorbedor depende del estado de
excitación del átomo (n), ya que
cuanto mayor es n, menor es la
velocidad del electrón en su órbita, pero mayor es la energía total del átomo.
Análogamente, cuando mayor es la energía total del electrón libre, menor es su
capacidad de absorber. La absorción dependerá entonces de la velocidad del electrón. Haciendo uso de
la Física Clásica, Kramers (1923) ha mostrado que la contribución de los procesos libre-libre al coeficiente de
absorción continua en cm2
por ión (protón) y por electrón libre moviéndose con velocidad entre v
y v+dv, está dada por :
, o bien de su velocidad v. Esto es así por analogía a lo que ocurre en el caso del átomo de
H neutro. En efecto, en este último caso y de acuerdo a la expresión (10.24),
el coeficiente de absorción an en cm2
por absorbedor depende del estado de
excitación del átomo (n), ya que
cuanto mayor es n, menor es la
velocidad del electrón en su órbita, pero mayor es la energía total del átomo.
Análogamente, cuando mayor es la energía total del electrón libre, menor es su
capacidad de absorber. La absorción dependerá entonces de la velocidad del electrón. Haciendo uso de
la Física Clásica, Kramers (1923) ha mostrado que la contribución de los procesos libre-libre al coeficiente de
absorción continua en cm2
por ión (protón) y por electrón libre moviéndose con velocidad entre v
y v+dv, está dada por :
![]() (10.41)
(10.41)
Si suponemos que los
electrones tienen una distribución Maxwelliana de velocidades, la absorción
completa o contribución total se
obtendrá multiplicando la contribución ![]() por la fracción de electrones
por la fracción de electrones ![]() expresada en (4.29) e
integrando este producto sobre la velocidad. Resulta así :
expresada en (4.29) e
integrando este producto sobre la velocidad. Resulta así :
 (10.42)
(10.42)
Para resolver la integral
anterior, hacemos la sustitución ![]() , de manera que
, de manera que ![]() . Con este cambio de variables se obtiene :
. Con este cambio de variables se obtiene :
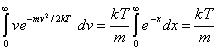 , (10.43)
, (10.43)
y la (10.42) puede
escribirse de la siguiente manera :
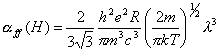 (10.44)
(10.44)
La derivación de Gaunt usando la Mecánica Cuántica
conduce a la misma expresión, aunque multiplicada por un factor ![]() , conocido como factor de Gaunt para las transiciones
libre-libre.
, conocido como factor de Gaunt para las transiciones
libre-libre.
Por consideraciones análogas al caso de las transiciones
ligado-libre, el coeficiente de absorción ![]() expresado en cm2 por átomo de H neutro, se obtiene multiplicando
expresado en cm2 por átomo de H neutro, se obtiene multiplicando ![]() por el cociente
por el cociente ![]() , en el cual
, en el cual ![]() y
y ![]() son los números de
iones (protones) y electrones por unidad de volumen, respectivamente, y
son los números de
iones (protones) y electrones por unidad de volumen, respectivamente, y ![]() el número de átomos
de H neutro por unidad de volumen. Este cociente puede obtenerse de la fórmula
de Saha (4.12) aplicada al H, a saber :
el número de átomos
de H neutro por unidad de volumen. Este cociente puede obtenerse de la fórmula
de Saha (4.12) aplicada al H, a saber :
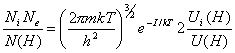 , (10.45)
, (10.45)
en la cual ![]() y
y ![]() son las funciones de
partición del átomo de H ionizado y neutro, respectivamente. Dado que el átomo
de H ionizado (protón) no posee electrones que puedan estar excitados, sólo
puede existir en una única forma. Su peso estadístico para el nivel fundamental
es entonces la unidad y la función de partición también, es decir,
son las funciones de
partición del átomo de H ionizado y neutro, respectivamente. Dado que el átomo
de H ionizado (protón) no posee electrones que puedan estar excitados, sólo
puede existir en una única forma. Su peso estadístico para el nivel fundamental
es entonces la unidad y la función de partición también, es decir, ![]() = 1. Por su parte, el átomo de H
neutro en el nivel fundamental puede existir en dos maneras diferentes, con su
único electrón con el spin hacia arriba o hacia abajo, de manera que el peso
estadístico del nivel fundamental es ahora 2. Las energias de excitación para
los restantes niveles (n > 1) son
tan elevadas que los números de partículas en estos estados pueden despreciarse
en comparación con el número de partículas en el nivel fundamental. Podemos
entonces aceptar que
= 1. Por su parte, el átomo de H
neutro en el nivel fundamental puede existir en dos maneras diferentes, con su
único electrón con el spin hacia arriba o hacia abajo, de manera que el peso
estadístico del nivel fundamental es ahora 2. Las energias de excitación para
los restantes niveles (n > 1) son
tan elevadas que los números de partículas en estos estados pueden despreciarse
en comparación con el número de partículas en el nivel fundamental. Podemos
entonces aceptar que ![]() = 2. La (10.45) se
transforma entonces en :
= 2. La (10.45) se
transforma entonces en :
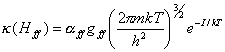 (10.46)
(10.46)
Finalmente, teniendo en cuenta (10.38) y (10.39),
considerando que ![]() es el potencial de
ionización del H neutro y que la constante de Rydberg es por, definición,
es el potencial de
ionización del H neutro y que la constante de Rydberg es por, definición, ![]() , resulta después de algunos pasos algebraicos :
, resulta después de algunos pasos algebraicos :
![]() , (10.47)
, (10.47)
en la cual : ![]() (10.48)
(10.48)
El factor de Gaunt necesario para calcular ![]() de (10.47) ha sido
tabulado por Karzas y Latter (1961), Gingerich (1964), y otros autores. Las
siguientes expresiones han sido dadas por Menzel y Pekeris (1935) para el
factor de Gaunt
de (10.47) ha sido
tabulado por Karzas y Latter (1961), Gingerich (1964), y otros autores. Las
siguientes expresiones han sido dadas por Menzel y Pekeris (1935) para el
factor de Gaunt ![]() :
:
![]() (10.49)
(10.49)
![]()
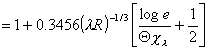 , (10.50)
, (10.50)
en la cual ![]() = 1.2398 x104/l es la energía del fotón cuando l está dada en
angstroms.
= 1.2398 x104/l es la energía del fotón cuando l está dada en
angstroms.
Hemos obtenido el coeficiente de opacidad continua en cm2 por átomo de H neutro, tanto para las transiciones ligado-libre
como para las libre-libre del átomo de H. Dado que la distribución espectral de
energía en las estrellas de tipos B, A y F muestra una fuerte modulación debida
al coeficiente de absorción del H neutro,
tenemos prácticamente resuelto el problema del coeficiente de absorción para
estas estrellas. En las estrellas más calientes de tipos espectrales O, el
hidrógeno neutro deja de ser el absorbedor continuo dominante en virtud de que
hay mucho menor cantidad de estos átomos. En este caso, dada la abundancia de
electrones libres, comienza a ser
importante la dispersión electrónica.
Por su parte, en los tipos espectrales G tempranos, como el Sol, veremos en
seguida que se dan las condiciones óptimas para la formación de iones negativos del H, por lo que el
espectro continuo en la región visible de estas estrellas, estará dominado por
la absorción de estos iones. Finalmente, en las estrellas tardias tipo M
abundan los compuestos moleculares y, por lo tanto, el proceso físico dominante
es ahora la dispersión Rayleigh.
10.8
EL IÓN NEGATIVO DEL HIDRÓGENO
En ciertas condiciones, el átomo de hidrógeno puede
capturar un segundo electrón y mantenerlo ligado. Cuando esto ocurre, el átomo
de H queda ionizado negativamente, por lo que se denomina ión negativo del hidrógeno y se lo denota con el símbolo ![]() . Si bien en la década del 30 cálculo teóricos basados en
la Mecánica Cuántica permitieron predecir la existencia de este ión, fue Wildt
(1939) quien por vez primera sugirió que los iones negativos del H son los
responsables de la mayor parte de la absorción continua observada en el Sol.
Cálculos muy precisos han confirmado que para liberar el segundo electrón del
. Si bien en la década del 30 cálculo teóricos basados en
la Mecánica Cuántica permitieron predecir la existencia de este ión, fue Wildt
(1939) quien por vez primera sugirió que los iones negativos del H son los
responsables de la mayor parte de la absorción continua observada en el Sol.
Cálculos muy precisos han confirmado que para liberar el segundo electrón del ![]() se requiere una energía de apenas 0.754 eV. Precisamente, dado que la energía de ligadura del segundo electrón
ligado es tan baja, un pequeño cambio en las condiciones del gas es suficiente
para que el
se requiere una energía de apenas 0.754 eV. Precisamente, dado que la energía de ligadura del segundo electrón
ligado es tan baja, un pequeño cambio en las condiciones del gas es suficiente
para que el ![]() expulse el
segundo electrón y se convierta nuevamente en un átomo de H neutro.
expulse el
segundo electrón y se convierta nuevamente en un átomo de H neutro.
El ![]() no se puede
excitar y por ende no da lugar a transiciones discretas, esto es, no existen
líneas espectrales debidas al
no se puede
excitar y por ende no da lugar a transiciones discretas, esto es, no existen
líneas espectrales debidas al ![]() . Cualquier fotón con una energía hn mayor que la energía de
ligadura del
. Cualquier fotón con una energía hn mayor que la energía de
ligadura del ![]() (0.754 eV) puede liberar el segundo electrón
ligado al
(0.754 eV) puede liberar el segundo electrón
ligado al ![]() y transformarlo
nuevamente en un átomo de H neutro. Un proceso de este tipo corresponde a una transición ligado-libre del
y transformarlo
nuevamente en un átomo de H neutro. Un proceso de este tipo corresponde a una transición ligado-libre del ![]() . Dado que un fotón con una energía de 0.754 eV tiene una longitud de onda asociada
de 16.450 Å, todos los fotones con longitudes de onda asociadas menores que
dicha cantidad tendrán suficiente energía como para fotoionizar el
. Dado que un fotón con una energía de 0.754 eV tiene una longitud de onda asociada
de 16.450 Å, todos los fotones con longitudes de onda asociadas menores que
dicha cantidad tendrán suficiente energía como para fotoionizar el ![]() y neutralizarlo.
Los cuantos de energía hn que pueden ser
absorbidos por el
y neutralizarlo.
Los cuantos de energía hn que pueden ser
absorbidos por el ![]() son infinitos y
varían con continuidad a partir de la energía umbral hn = 0.754 eV, de manera pues que las transiciones
radiativas ligado-libre del
son infinitos y
varían con continuidad a partir de la energía umbral hn = 0.754 eV, de manera pues que las transiciones
radiativas ligado-libre del ![]() contribuyen al
espectro continuo.
contribuyen al
espectro continuo.
El ![]() no sólo puede
absorber energía mediante transiciones ligado-libre como las descriptas
precedentemente, sino que también pueden ocurrir transiciones libre-libre producidas por este ión. En efecto, puede
ocurrir una transición libre-libre como resultado de una interacción entre un
átomo de H neutro y un electrón. El conjunto formado por estas dos partículas,
aún cuando el electrón no esté ligado al átomo, constituye un sistema tipo
no sólo puede
absorber energía mediante transiciones ligado-libre como las descriptas
precedentemente, sino que también pueden ocurrir transiciones libre-libre producidas por este ión. En efecto, puede
ocurrir una transición libre-libre como resultado de una interacción entre un
átomo de H neutro y un electrón. El conjunto formado por estas dos partículas,
aún cuando el electrón no esté ligado al átomo, constituye un sistema tipo ![]() , de la misma manera que un protón y un electrón, aún
cuando este último no esté ligado al protón, constituye un sistema tipo átomo de H neutro. La única diferencia entre un protón
y un electrón libre y el átomo de H neutro radica en el hecho de que el
electrón del primer sistema tiene energías positivas y no negativas, como en el
átomo de H neutro. Podríamos decir, en este caso, que el electrón se encuentra debilmente ligado al protón.
Análogamente, cuando se considera un electrón libre y un átomo de H neutro,
puede considerarse que en cierta manera el electrón se encuentra débilmente
ligado al átomo de H neutro, constituyendo en conjunto un sistema tipo
, de la misma manera que un protón y un electrón, aún
cuando este último no esté ligado al protón, constituye un sistema tipo átomo de H neutro. La única diferencia entre un protón
y un electrón libre y el átomo de H neutro radica en el hecho de que el
electrón del primer sistema tiene energías positivas y no negativas, como en el
átomo de H neutro. Podríamos decir, en este caso, que el electrón se encuentra debilmente ligado al protón.
Análogamente, cuando se considera un electrón libre y un átomo de H neutro,
puede considerarse que en cierta manera el electrón se encuentra débilmente
ligado al átomo de H neutro, constituyendo en conjunto un sistema tipo![]() . El electrón libre, en este último caso, dispone de un
conjunto continuo de energías positivas permitidas. Por lo tanto, un electrón
desplazándose en una órbita hiperbólica alrededor de un átomo de H neutro,
puede absorber un fotón hn y pasar a otra
órbita hiperbólica más lejana. En este caso, se dice que hubo una contribución
al coeficiente de absorción continua debido a una transición ligado-libre del
. El electrón libre, en este último caso, dispone de un
conjunto continuo de energías positivas permitidas. Por lo tanto, un electrón
desplazándose en una órbita hiperbólica alrededor de un átomo de H neutro,
puede absorber un fotón hn y pasar a otra
órbita hiperbólica más lejana. En este caso, se dice que hubo una contribución
al coeficiente de absorción continua debido a una transición ligado-libre del ![]() .
.
Podríamos preguntarnos qué condiciones físicas y químicas
deben existir en una fotosfera para que puedan formarse iones negativos del H ?
Esencialmente se requiere una mezcla de átomos de H neutro con átomos de otros
elementos químicos cuyos potenciales de ionización sean muy bajos en
comparación con el potencial de ionización de H. Esta mezcla debe encontrarse
naturalmente a baja temperatura, para permitir que los electrones que han
escapado de los átomos de bajo potencial de ionización puedan ligarse
fácilmente a los átomos de H neutro y formar iones ![]() estables. Si una fotosfera estelar estuviese íntegramente
constituida por átomos de H neutro, la baja temperatura requerida para la
estabilidad del
estables. Si una fotosfera estelar estuviese íntegramente
constituida por átomos de H neutro, la baja temperatura requerida para la
estabilidad del ![]() no permitiría que existieran
electrones libres debido a que el potencial de ionización del átomo de H (13.6 eV) es mucho mayor que la energía
necesaria para formar el
no permitiría que existieran
electrones libres debido a que el potencial de ionización del átomo de H (13.6 eV) es mucho mayor que la energía
necesaria para formar el ![]() (0.754 eV). En consecuencia, no sería posible
encontrar iones
(0.754 eV). En consecuencia, no sería posible
encontrar iones ![]() en una fotosfera de
puro H neutro, aún cuando la misma se encontrara a bajas temperaturas.
en una fotosfera de
puro H neutro, aún cuando la misma se encontrara a bajas temperaturas.
¿ En qué tipos espectrales se dan las condiciones para la
formación de iones negativos del hidrógeno en cantidades apreciables ? Podemos
mostrar que las temperaturas y presiones electrónicas típicas de los tipos
espectrales tardíos, próximos al tipo solar, son apropiadas para la formación
del ![]() . En efecto, si se trata el caso particular de la fotosfera
solar y se suponen condiciones de equilibrio termodinámico, la proporción de
iones
. En efecto, si se trata el caso particular de la fotosfera
solar y se suponen condiciones de equilibrio termodinámico, la proporción de
iones ![]() respecto de átomos de
H neutro, o viceversa, puede obtenerse a partir de la ley de Saha (4.14)
escrita de la siguiente manera :
respecto de átomos de
H neutro, o viceversa, puede obtenerse a partir de la ley de Saha (4.14)
escrita de la siguiente manera :
![]() , (10.51)
, (10.51)
en la cual ![]() y
y ![]() representan los números de átomos de H neutros y iones
representan los números de átomos de H neutros y iones ![]() por unidad de
volumen, respectivamente,
por unidad de
volumen, respectivamente, ![]() es la función de
partición del
es la función de
partición del ![]() , I
, I![]() el potencial de ionización del
el potencial de ionización del ![]() , Q = 5040/T
y Pe la presión
electrónica. Nótese que el ión
, Q = 5040/T
y Pe la presión
electrónica. Nótese que el ión ![]() no tiene estados
excitados con energías menores que la energía de ionización, de manera que para
calcular la función del partición del
no tiene estados
excitados con energías menores que la energía de ionización, de manera que para
calcular la función del partición del ![]() sólo tenemos que
considerar el peso estadístico del nivel fundamental. Si bien el
sólo tenemos que
considerar el peso estadístico del nivel fundamental. Si bien el ![]() tiene dos electrones
ligados, ambos están en el nivel n =
1. De acuerdo al Pricipio de Pauli, estos dos electrones no pueden tener todos
sus números cuánticos iguales, por lo que la única configuración posible para
el
tiene dos electrones
ligados, ambos están en el nivel n =
1. De acuerdo al Pricipio de Pauli, estos dos electrones no pueden tener todos
sus números cuánticos iguales, por lo que la única configuración posible para
el ![]() es que un electrón
tenga su spin para arriba y el otro para abajo. Esto significa que el peso
estadístico del
es que un electrón
tenga su spin para arriba y el otro para abajo. Esto significa que el peso
estadístico del ![]() en el nivel
fundamental debe ser la unidad, o sea,
en el nivel
fundamental debe ser la unidad, o sea, ![]() = 1.
= 1.
Para una región
típica fotosférica en el Sol T » 6000 K (Q = 0.84) y log Pe (dinas/cm2) = 1.5, de manera que (10.51) implica :
![]() x
x![]() , (10.52)
, (10.52)
lo que equivale a decir que,
en las condiciones consideradas y en la unidad de volumen, existen
aproximadamente unos 25 millones de átomos de H neutro en la fotosfera solar
por cada ![]() . Este resultado aparenta contradecir la aseveración original
de Wildt (1939), en el sentido de que los iones
. Este resultado aparenta contradecir la aseveración original
de Wildt (1939), en el sentido de que los iones ![]() son los responsables de la mayor parte de la absorción
continua observada en el Sol. Veremos, sin embargo, que no existe tal
contradicción.
son los responsables de la mayor parte de la absorción
continua observada en el Sol. Veremos, sin embargo, que no existe tal
contradicción.
Comparemos la cantidad de iones ![]() por unidad de
volumen, con el número de átomos de H neutro por unidad de volumen en
condiciones de absorber energía en la región visible del espectro. En
particular, si llamamos
por unidad de
volumen, con el número de átomos de H neutro por unidad de volumen en
condiciones de absorber energía en la región visible del espectro. En
particular, si llamamos ![]() a la densidad de
átomos de H neutro en el tercer nivel (n
= 3) en condiciones de absorber el continuo de Paschen, la fórmula de Boltzmann
(4.9) implica :
a la densidad de
átomos de H neutro en el tercer nivel (n
= 3) en condiciones de absorber el continuo de Paschen, la fórmula de Boltzmann
(4.9) implica :
![]() , (10.53)
, (10.53)
en la cual ![]() es el peso
estadístico del tercer nivel del H y
es el peso
estadístico del tercer nivel del H y ![]() el
correspondiente potencial de excitación.
Dado que para el átomo de H es
el
correspondiente potencial de excitación.
Dado que para el átomo de H es ![]() , entonces
, entonces ![]() = 18. Además, puesto
que I = 13.6 eV y de (10.30) se obtiene
= 18. Además, puesto
que I = 13.6 eV y de (10.30) se obtiene ![]() = 12.09, resulta :
= 12.09, resulta :
![]() x109, (10.54)
x109, (10.54)
De (10.53) y 10.54) resulta :
![]() (10.55)
(10.55)
Existe pues un gran número de iones ![]() en comparación con el
número de átomos del H neutro en condiciones de absorber el continuo de
Paschen. Puede mostrarse que el número de iones
en comparación con el
número de átomos del H neutro en condiciones de absorber el continuo de
Paschen. Puede mostrarse que el número de iones ![]() es también mayor que
el de átomos de H neutro en condiciones de absorber el continuo de Balmer y aún
mayor que el de átomos de H neutro en condiciones de absorber las restantes
series espectrales del H. En efecto, los cálculos muestran que :
es también mayor que
el de átomos de H neutro en condiciones de absorber el continuo de Balmer y aún
mayor que el de átomos de H neutro en condiciones de absorber las restantes
series espectrales del H. En efecto, los cálculos muestran que :
![]()
![]()
![]()
![]() 160 , etc
160 , etc
Llegamos entonces a la conclusión de que, en las
condiciones consideradas, no obstante ser los iones ![]() mucho menos
abundantes que los átomos de H neutro, prevalecen numéricamente cuando se los
compara con los átomos de H en condiciones de absorber en la región visible e
infrarroja del espectro. Ésta es la razón por la cual la contribución del
mucho menos
abundantes que los átomos de H neutro, prevalecen numéricamente cuando se los
compara con los átomos de H en condiciones de absorber en la región visible e
infrarroja del espectro. Ésta es la razón por la cual la contribución del ![]() a la opacidad
continua en las fotosferas tipo solar, es mucho mayor en la región visible e
infrarroja del espectro que la contribución de los átomos de H neutro.
a la opacidad
continua en las fotosferas tipo solar, es mucho mayor en la región visible e
infrarroja del espectro que la contribución de los átomos de H neutro.
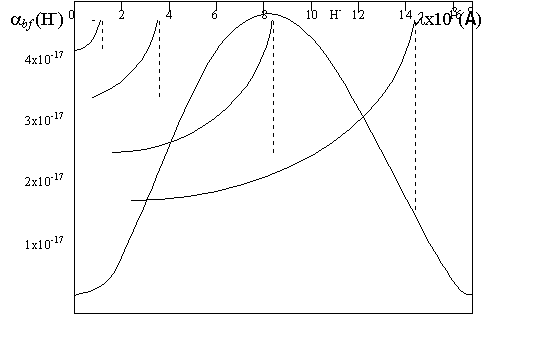
Figura 10-4 :
Coeficiente de absorción continua debido a las transiciones ligado-libre
del ión negativo del hidrógeno, comparado con el correspondiente al átomo
de H neutro en el nivel fundamental y en sus primeros estados excitados.
Dado que el potencial de ionización del ![]() es 0.754 eV, la absorción continua debida a la
fotodisociación del
es 0.754 eV, la absorción continua debida a la
fotodisociación del ![]() se extiende desde l = hc/0.754 eV = 16450 Å en el infrarrojo hacia las longitudes de onda más
cortas, cubriendo todo el rango espectral visible con un máximo en
aproximadamente 8500 Å (Figura 10-4).
La importancia astrofísica del
se extiende desde l = hc/0.754 eV = 16450 Å en el infrarrojo hacia las longitudes de onda más
cortas, cubriendo todo el rango espectral visible con un máximo en
aproximadamente 8500 Å (Figura 10-4).
La importancia astrofísica del ![]() radica precisamente
en que los cuantos de energía de la región visible e infrarroja del espectro
pueden fotodisociar este ión. Nótese de paso que la fotodisociación del
radica precisamente
en que los cuantos de energía de la región visible e infrarroja del espectro
pueden fotodisociar este ión. Nótese de paso que la fotodisociación del ![]() equivale a una
transición radiativa ligado-libre del ión negativo del hidrógeno.
equivale a una
transición radiativa ligado-libre del ión negativo del hidrógeno.
Varios autores han llevado a cabo complicados cálculos
teóricos del coeficiente de absorción continua del ![]() debido a las
transiciones ligado-libre. Los primeros esfuerzos realizados, entre otros, por
Massey y Bates (1940) y Wheeler y Wildt (1942), fueron sólo parcialmente
exitosos y muy poco después mejorados por Chandrasekhar y sus colaboradores.
Cálculos detallados fueron posteriormente realizados por Ohmura y Ohmura
(1960), Geltman (1962), Doughty et al. (1966) y Krogdahl y Miller (1967). Todos estos cáculos demuestran que el
coeficiente de absorción
debido a las
transiciones ligado-libre. Los primeros esfuerzos realizados, entre otros, por
Massey y Bates (1940) y Wheeler y Wildt (1942), fueron sólo parcialmente
exitosos y muy poco después mejorados por Chandrasekhar y sus colaboradores.
Cálculos detallados fueron posteriormente realizados por Ohmura y Ohmura
(1960), Geltman (1962), Doughty et al. (1966) y Krogdahl y Miller (1967). Todos estos cáculos demuestran que el
coeficiente de absorción ![]() debido a las
transiciones ligado-libre del
debido a las
transiciones ligado-libre del ![]() no varía con el cubo de la longitud de onda, como acontece
con el átomo de H neutro. Por el contrario,
no varía con el cubo de la longitud de onda, como acontece
con el átomo de H neutro. Por el contrario, ![]() es aproximadamente
constante en un rango espectral relativamente amplio. De la Figura 10-4 se aprecia que el
coeficiente de absorción ligado-libre del
es aproximadamente
constante en un rango espectral relativamente amplio. De la Figura 10-4 se aprecia que el
coeficiente de absorción ligado-libre del ![]() tiene un máximo cuyo
valor supera en aproximadamente un orden de magnitud al correspondiente
coeficiente ligado-libre del átomo de H neutro. Nótese además que el máximo del
aporte del
tiene un máximo cuyo
valor supera en aproximadamente un orden de magnitud al correspondiente
coeficiente ligado-libre del átomo de H neutro. Nótese además que el máximo del
aporte del ![]() ocurre
aproximadamente en 8500 Å y, en la región visible entre 4500 Å y 7000 Å, dicho
coeficiente varía bastante poco con la longitud de onda. De acuerdo a Geltman
(1962), los siguientes polinomios ajustan muy bien el coeficiente
ocurre
aproximadamente en 8500 Å y, en la región visible entre 4500 Å y 7000 Å, dicho
coeficiente varía bastante poco con la longitud de onda. De acuerdo a Geltman
(1962), los siguientes polinomios ajustan muy bien el coeficiente ![]() :
:
![]() x
x ![]()
![]() x
x![]()
![]() x
x ![]() , (10.56)
, (10.56)
válido para 1500Å < l < 5250Å y :
![]() x
x ![]()
![]() x
x ![]()
![]() x
x ![]() , (10.57)
, (10.57)
válido para 5250Å < l < 11250Å, y :
![]() x
x ![]()
![]() x
x ![]()
![]() x
x ![]() , (10.58)
, (10.58)
válido para 11250Å < l < 15000Å.
El coeficiente ![]() en los polinomios
anteriores está expresado en cm2
por ión
en los polinomios
anteriores está expresado en cm2
por ión ![]() y por unidad de
presión electrónica. Nótese que en ningún caso se ha incluido el factor de
emisiones estimuladas.
y por unidad de
presión electrónica. Nótese que en ningún caso se ha incluido el factor de
emisiones estimuladas.
Para obtener el coeficiente ![]() de absorción continua
debido a las transiciones ligado-libre del
de absorción continua
debido a las transiciones ligado-libre del ![]() , expresado en cm2
por átomo de H neutro, tenemos que
multiplicar
, expresado en cm2
por átomo de H neutro, tenemos que
multiplicar ![]() por la fracción de
iones
por la fracción de
iones ![]() respecto del número
de átomos de H neutro. De las expresiones (4.16) y (4.17) se tiene :
respecto del número
de átomos de H neutro. De las expresiones (4.16) y (4.17) se tiene :
![]() x
x ![]() x
x ![]() , (10.59)
, (10.59)
en la cual se ha tenido en
cuenta que ![]() = 1 y
= 1 y ![]() = 2. Dado que
= 2. Dado que ![]() eV, resulta :
eV, resulta :
![]() x
x![]() (10.60)
(10.60)
La componente libre-libre del ![]() se hace importante recién en el infrarrojo. Los cálculos
teóricos son bastante complejos y han sido realizados, entre otros, por
Chandrasekhar y Breen (1946), John (1966), Geltman (1965), Doughty y Fraser
(1966) y Stilley y Callaway (1970). En la Figura
10-5 se muestra el comportamiento en función de la longitud de onda del
coeficiente
se hace importante recién en el infrarrojo. Los cálculos
teóricos son bastante complejos y han sido realizados, entre otros, por
Chandrasekhar y Breen (1946), John (1966), Geltman (1965), Doughty y Fraser
(1966) y Stilley y Callaway (1970). En la Figura
10-5 se muestra el comportamiento en función de la longitud de onda del
coeficiente ![]() expresado en cm2 por ión
expresado en cm2 por ión ![]() , de acuerdo a los cálculos teóricos de Stilley y Callaway
(1970). Este coeficiente se hace claramente importante en el infrarrojo y es
mayor cuanto menor es la temperatura. Si bien en las estrellas M deberia ser
teóricamente importante, en estas estrellas no hay electrones libres como para
formar el
, de acuerdo a los cálculos teóricos de Stilley y Callaway
(1970). Este coeficiente se hace claramente importante en el infrarrojo y es
mayor cuanto menor es la temperatura. Si bien en las estrellas M deberia ser
teóricamente importante, en estas estrellas no hay electrones libres como para
formar el ![]() .
.
Figura 10-5 :
Comportamiento del coeficiente
![]() en cm2 por
en cm2 por ![]() de acuerdo a los
cálculos de Stilley y Callaway (1970).
de acuerdo a los
cálculos de Stilley y Callaway (1970).
El siguiente
polinomio ajusta dentro del 1% los cálculos de Stilley y Callaway (1970) en el
rango espectral 3038-91130 Å y para temperaturas entre 2500 oK y
10.100 oK :
![]() , (10.61)
, (10.61)
en el cual es :
![]() ,
,
![]() ,
,
![]() ,
,
y la emisión estimulada ya
ha sido tenida en cuenta en (10.61). Si bien el gráfico de la Figura 10-5 vale para una determinada
presión electrónica Pe, la
tendencia manifiesta en el diagrama es independiente de Pe.
En la Figura 10-6
se ilustra el comportamiento del coeficiente de absorción continua del ión ![]() para una temperatura
de 6300 oK, debido a transiciones ligado-libre y libre-libre. La
cantidad graficada es 1026 veces el coeficiente de absorción por
átomo de H neutro y por unidad de Pe.
para una temperatura
de 6300 oK, debido a transiciones ligado-libre y libre-libre. La
cantidad graficada es 1026 veces el coeficiente de absorción por
átomo de H neutro y por unidad de Pe.
5 4 3 2 1 0![]()
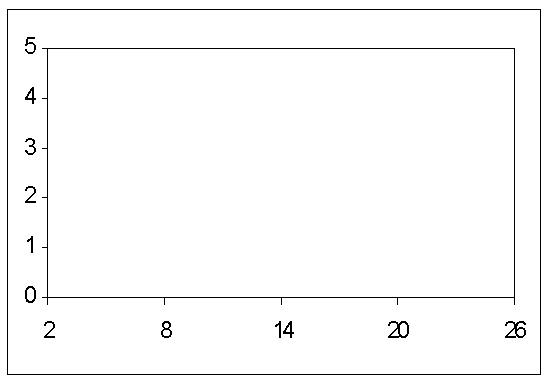
2 8 14 20 26

Figura 10-6 :
Coeficiente de absorción continua debido a las transiciones ligado-libre y
libre-libre del ión negativo del H, para una temperatura de 6.300 oK.
La cantidad graficada es 1026 veces el coeficiente de absorción
por átomo de H neutro y por unidad de presión electrónica.
10.9
ABSORCIÓN CONTINUA DEBIDA A LA MOLÉCULA DE HIDRÓGENO
Otro absorbedor continuo hidrogenoide es la molécula de
hidrógeno H2, cuya abundancia supera la del hidrógeno atómico en las
estrellas tipo M. Si bien esta molécula no absorbe en la región del visible, si
lo hacen sus respectivos iones ![]() y
y ![]() . El ión positivo
. El ión positivo ![]() consiste de dos
protones y un electrón, en tanto que el ión
consiste de dos
protones y un electrón, en tanto que el ión ![]() está formado por dos
protones y tres electrones. Dado que la densidad de iones
está formado por dos
protones y tres electrones. Dado que la densidad de iones ![]() es proporcional al
producto de la densidad de atomos de H neutro por la densidad de protones, el
ión positivo
es proporcional al
producto de la densidad de atomos de H neutro por la densidad de protones, el
ión positivo ![]() contribuye en forma
significativa a la opacidad continua sólo en un rango de temperaturas y
presiones dentro del cual existen protones y átomos de H neutro en cantidades
apreciables. Este rango ocurre precisamente en las fotosferas de las estrellas
de tipo A, en las cuales existen aproximadamente las mismas cantidades de H
neutro y ionizado. De allí que aproximadamente el 10% de la opacidad continua
en el visible de estas estrellas se debe al aporte del ión
contribuye en forma
significativa a la opacidad continua sólo en un rango de temperaturas y
presiones dentro del cual existen protones y átomos de H neutro en cantidades
apreciables. Este rango ocurre precisamente en las fotosferas de las estrellas
de tipo A, en las cuales existen aproximadamente las mismas cantidades de H
neutro y ionizado. De allí que aproximadamente el 10% de la opacidad continua
en el visible de estas estrellas se debe al aporte del ión ![]() . La contribución de este ión a la opacidad continua ha sido
estudiada, entre otros, por Bates (1951, 1952), Buckingham et al. (1952),
Ledsham y Stewart (1953) y Matsushima (1964). Este último demostró que para
estrellas frias, la contribución del ión
. La contribución de este ión a la opacidad continua ha sido
estudiada, entre otros, por Bates (1951, 1952), Buckingham et al. (1952),
Ledsham y Stewart (1953) y Matsushima (1964). Este último demostró que para
estrellas frias, la contribución del ión ![]() es menor que el 10%
de la del
es menor que el 10%
de la del ![]() para l > 4000 Å. Doyle (1968) estudió la absorción
producida por la llamada molécula cuasi-H2
y encontró que su contribución es significativa en la región del ultravioleta (l < 2500 Å) y
en estrellas tipo solar.
para l > 4000 Å. Doyle (1968) estudió la absorción
producida por la llamada molécula cuasi-H2
y encontró que su contribución es significativa en la región del ultravioleta (l < 2500 Å) y
en estrellas tipo solar.
Por su parte, el ión ![]() existe sólo a
temperaturas comparativamente bajas propias de las estrellas M. Si bien los
procesos ligado-libre de este absorbedor son prácticamente despreciables, no lo
son los procesos libre-libre, los cuales aportan en forma significativa en el
infrarrojo lejano. Los coeficientes de absorción debidos a transiciones
libre-libre del ión
existe sólo a
temperaturas comparativamente bajas propias de las estrellas M. Si bien los
procesos ligado-libre de este absorbedor son prácticamente despreciables, no lo
son los procesos libre-libre, los cuales aportan en forma significativa en el
infrarrojo lejano. Los coeficientes de absorción debidos a transiciones
libre-libre del ión ![]() han sido calculados,
entre otros, por Somerville (1964) y Dalgarno y Lane (1966). El coeficiente de
absorción de acuerdo a estos últimos autores es :
han sido calculados,
entre otros, por Somerville (1964) y Dalgarno y Lane (1966). El coeficiente de
absorción de acuerdo a estos últimos autores es :
![]() x
x ![]()
![]()
![]() cm4 dinas-1 , (10.62)
cm4 dinas-1 , (10.62)
en la cual a = (1.439 x 108)/kT, con l medida en anstroms.
10.10
OPACIDAD CONTINUA DEBIDA AL HELIO
10.10.1
Contribución del HeI y HeII
Puesto que el He es el elemento más abundante después del
hidrógeno en la gran mayoría de las estrellas, podría pensarse que su
contribución al coeficiente de absorción continua debe ser también apreciable.
Ciertamente, en algunas estrellas con abundancias anormalmente grandes de He,
la opacidad continua puede estar dominada por este elemento químico. Recordemos
que el He se observa en los espectros estelares, tanto en estado neutro como en
estado una vez ionizado. Sin embargo, dado que el potencial de ionización del
HeI es bastante elevado (24.58 eV),
su contribución se aprecia sólo en estrellas O y B a elevadas temperaturas, en
las cuales el H está fuertemente ionizado. Los primeros niveles del HeI tienen
energías de excitación de alrededor de 20 eV
y el borde de absorción a partir del nivel fundamental yace en 504 Å, de manera
que la contribución de este elemento será importante sólo en el ultravioleta
lejano de estrellas tempranas. Como en el caso del H, el coeficiente de
absorción del HeI en una determinada longitud de onda, se obtiene sumando las
contribuciones de cada uno de los continuos que se extienden más allá de las
diferentes series espectrales de este elemento. Para una temperatura
típicamente solar (6000 oK), la fórmula de Boltzmann (4.3) implica:
![]() , (10.63)
, (10.63)
en la cual el cociente
indica la fracción de átomos de He en el primer nivel excitado (n = 2) respecto de átomos de He en el
nivel fundamental (n = 1). A estas
temperaturas prácticamente todos los átomos de He se encuentran en el nivel
fundamental. Si bien pueden ocurrir transiciones ligado-libre desde el nivel
fundamental en longitudes de onda más cortas que l = 504 Å, es
muy pequeña la radiación que emite el Sol en esta región del espectro.
A muy elevadas temperaturas, características de las
estrellas O, tanto el H como el He se encuentran altamente ionizados. En estas
condiciones, la contribución del HeII como fuente de opacidad continua puede
comenzar a ser importante. Este ión consiste en un electrón y un núcleo con
carga Z = 2, siendo su energía de
ionización de 54.4 eV. Debido a que
la opacidad del HeII depende fuertemente de la temperatura, normalmente puede
despreciarse su contribución, excepto para las estrellas B0 o más tempranas. El
HeII puede contribuir también en las capas más profundas de estrellas algo más
frías que las mencionadas. Ueno et al. (1954) han publicado tablas con valores
del coeficiente de absorción del HeI para temperaturas entre 10.080 oK
y 50.400 oK y del coeficiente de absorción del HeII, para
temperaturas entre 25.200 oK y 50.400 oK en ambos casos
en la región del ultravioleta entre 228 Å y 2279 Å.
10.10.2
El ión negativo del helio
El ión negativo del helio, denotado ![]() , se forma cuando un átomo de He con dos electrones y dos
protones, captura un tercer electrón y lo mantiene ligado al átomo. La energía
de ligadura del tercer electrón ligado es de 19 eV, es decir, se trata de una energía bastante apreciable. Al igual
que el ión
, se forma cuando un átomo de He con dos electrones y dos
protones, captura un tercer electrón y lo mantiene ligado al átomo. La energía
de ligadura del tercer electrón ligado es de 19 eV, es decir, se trata de una energía bastante apreciable. Al igual
que el ión ![]() , el ión
, el ión ![]() no se puede excitar,
esto es, no existen posibles transiciones
ligado-ligado del
no se puede excitar,
esto es, no existen posibles transiciones
ligado-ligado del ![]() . Cualquier fotón con una energía hn mayor que 19 eV podrá ionizar el ión
. Cualquier fotón con una energía hn mayor que 19 eV podrá ionizar el ión ![]() y transformarlo
nuevamente en un átomo de He neutro. Dado que la longitud de onda asociada a
este fotón es 652 Å, todos los fotones
con l £ 652 Å están en condiciones
de producir transiciones ligado-libre
del
y transformarlo
nuevamente en un átomo de He neutro. Dado que la longitud de onda asociada a
este fotón es 652 Å, todos los fotones
con l £ 652 Å están en condiciones
de producir transiciones ligado-libre
del ![]() . Estas transiciones, sin embargo, son despreciables para casi todas las estrellas, excepto quizás para
las estrellas O muy calientes. Esto se debe a que la gran mayoría de las
estrellas no irradian energías suficientemente grandes como para arrancar el
tercer electrón ligado al ión
. Estas transiciones, sin embargo, son despreciables para casi todas las estrellas, excepto quizás para
las estrellas O muy calientes. Esto se debe a que la gran mayoría de las
estrellas no irradian energías suficientemente grandes como para arrancar el
tercer electrón ligado al ión ![]() .
.
Un proceso libre-libre del ión ![]() ocurre por
interacción de un átomo de He neutro con un electrón con energía positiva. Si
el electrón libre moviéndose en el campo del átomo de He neutro absorbe un
fotón, cambiará su órbita hiperbólica, alejándose del átomo. Dado que las
energías que pueden ser absorbidas por este proceso son infinitas y varían con
continuidad, los procesos libre-libre del
ocurre por
interacción de un átomo de He neutro con un electrón con energía positiva. Si
el electrón libre moviéndose en el campo del átomo de He neutro absorbe un
fotón, cambiará su órbita hiperbólica, alejándose del átomo. Dado que las
energías que pueden ser absorbidas por este proceso son infinitas y varían con
continuidad, los procesos libre-libre del ![]() contribuyen a la
opacidad continua. Estos procesos pueden ser importantes en particular para
longitudes de onda grandes y en estrellas frías. McDowell et al. (1966) y John
(1968) han calculado teóricamente el coeficiente de absorción continua
contribuyen a la
opacidad continua. Estos procesos pueden ser importantes en particular para
longitudes de onda grandes y en estrellas frías. McDowell et al. (1966) y John
(1968) han calculado teóricamente el coeficiente de absorción continua ![]() para las transiciones
libre-libre del
para las transiciones
libre-libre del ![]() , y han incluído en sus cálculos las emisiones estimuladas.
El siguiente polinomio ajusta muy bien los resultados de McDowell et al. (1966)
:
, y han incluído en sus cálculos las emisiones estimuladas.
El siguiente polinomio ajusta muy bien los resultados de McDowell et al. (1966)
:
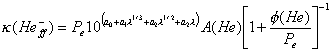 , (10.64)
, (10.64)
en el cual el término
exponencial está expresado en cm2
por átomo de HeI y ![]() es la abundancia
relativa (por número de átomos) del He respecto del H; es decir,
es la abundancia
relativa (por número de átomos) del He respecto del H; es decir, ![]() = (HeI+HeII)/NH representa el cociente entre el número de partículas
de helio (HeI + HeII), por unidad de
volumen, sobre el número
= (HeI+HeII)/NH representa el cociente entre el número de partículas
de helio (HeI + HeII), por unidad de
volumen, sobre el número ![]() de partículas de
hidrógeno (HI + protones), por unidad
de volumen. Nótese que el factor entre corchetes en (10.64) tiene en cuenta la
ionización del He a elevadas temperaturas. En efecto, si se aplica la fórmula
de Saha (4.16) al átomo de He, se tiene :
de partículas de
hidrógeno (HI + protones), por unidad
de volumen. Nótese que el factor entre corchetes en (10.64) tiene en cuenta la
ionización del He a elevadas temperaturas. En efecto, si se aplica la fórmula
de Saha (4.16) al átomo de He, se tiene :
![]() , (10.65)
, (10.65)
en la cual el primer miembro
representa el cociente entre el número de átomos de He ionizados, por unidad de
volumen, respecto del número de átomos de He neutro, por unidad de volumen, y ![]() es la función de
partición correspondiente al He neutro. La (10.65) puede escribirse como :
es la función de
partición correspondiente al He neutro. La (10.65) puede escribirse como :
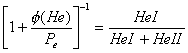 , (10.65)
, (10.65)
de manera que el coeficiente
![]() en (10.64) resulta expresado en cm2 por partícula
de H y por unidad de presión
electrónica. Los coeficientes
en (10.64) resulta expresado en cm2 por partícula
de H y por unidad de presión
electrónica. Los coeficientes ![]() en (10.64) son :
en (10.64) son :
![]()
![]()
![]()
![]()
Además de los iones negativos ![]() y
y ![]() , existen también iones negativos correspondientes a otros
elementos químicos o a compuestos moleculares que aportan a la opacidad
continua. Brascomb y Pagel (1967), por ejemplo, analizaron la posible
importancia astrofísica de la absorción producida por iones negativos tales
como
, existen también iones negativos correspondientes a otros
elementos químicos o a compuestos moleculares que aportan a la opacidad
continua. Brascomb y Pagel (1967), por ejemplo, analizaron la posible
importancia astrofísica de la absorción producida por iones negativos tales
como ![]() ,
, ![]() ,
, ![]() ,
, ![]() y
y ![]() . Estos autores llegaron a la conclusión de que los iones
negativos
. Estos autores llegaron a la conclusión de que los iones
negativos ![]() y
y ![]() son los más
importantes. Por su parte, Vardya (1967) ha mostrado que otros iones negativos
tales como
son los más
importantes. Por su parte, Vardya (1967) ha mostrado que otros iones negativos
tales como ![]() ,
, ![]() y
y ![]() , se presentan con cierta abundancia en estrellas tardías y
es posible que en ellas estos iones contribuyan levemente.
, se presentan con cierta abundancia en estrellas tardías y
es posible que en ellas estos iones contribuyan levemente.
10.11
OPACIDAD CONTINUA DEBIDA A LOS METALES
Además del H y del He contribuyen a la opacidad continua
los metales en general, cuyas absorciones ligado-libre pueden ser importantes
en la región del ultravioleta. Esfuerzos pioneros en el cálculo de coeficientes
de absorción de algunos metales han sido realizados, entre otros, por Vitense
(1951) y Seaton (1958). Una manera de determinar el coeficiente de absorción de
los metales es tomar las secciones transversales calculadas teóricamente
(cuando existen) y multiplicarlas por el respectivo número de absorbedores. De
esta manera Rich (1967), por ejemplo, obtuvo para el silicio el valor 37x10-18
cm2 por absorbedor para el estado fundamental, con lo que fue posible
demostrar que para T = 5600 K y Pe
= 10 dinas/cm2, el silicio
domina la opacidad metálica en el ultravioleta entre aproximadamente 1300 Å y
2000 Å. En muchos casos, sin embargo, las secciones transversales no se conocen
con precisión. Peach (1967) y Travis y Matsushima (1968) utilizaron el método conocido como del defecto cuántico (Burgess y Seaton 1960)
y produjeron extensas tablas con coeficientes de absorción. Sobre la base de
cálculos simples, Böhm-Vitense (1989) ha mostrado que en una fotosfera tipo
solar y en el ultravioleta (l = 2000 Å), las absorciones
metálicas - particularmente del Fe - son mucho más importantes que las
producidas por el ión ![]() o el átomo de H
neutro.
o el átomo de H
neutro.
10.12
DISPERSIÓN POR ELECTRONES
Como se mencionara en las Secciones 6.8 y 10.2, la
radiación continua puede ser no sólo absorbida realmente, sino también
dispersada dando lugar a una absorción
aparente. En el primer caso el fotón desaparece y su energía contribuye a
incrementar al menos parcialmente la energía térmica del gas, en tanto que en
el proceso de dispersión o scattering
el fotón no desaparece, sino que es desviado respecto de su dirección original,
pudiendo incluso modificarse ligeramente su frecuencia (dispersión no coherente).
La dispersión de la radiación producida por electrones
libres se conoce como dispersión
electrónica o scattering Thompson.
La fórmula clásica de Thompson, cuya deducción puede verse en Mihalas (1970),
indica que el coeficiente de scattering (sección transversal) del electrón está
dado por :
 , (10.66)
, (10.66)
en la cual e y m
representan la carga y la masa del electrón, respectivamente, y ![]() está expresado en cm2 por electrón. Es decir, este coeficiente equivale a 8/3 de la
sección eficaz del electrón calculada a partir del radio clásico del mismo,
está expresado en cm2 por electrón. Es decir, este coeficiente equivale a 8/3 de la
sección eficaz del electrón calculada a partir del radio clásico del mismo, ![]() . Es importante notar que el coeficiente
. Es importante notar que el coeficiente ![]() es independiente de la frecuencia de la
radiación incidente. De medidas cuidadosas realizadas en el laboratorio se
obtiene para este coeficiente el siguiente valor :
es independiente de la frecuencia de la
radiación incidente. De medidas cuidadosas realizadas en el laboratorio se
obtiene para este coeficiente el siguiente valor :
![]() , (10.67)
, (10.67)
el cual ha sido verificado
por cálculos realizados con ayuda de la Mecánica Cuántica en el límite
correspondiente a fotones de baja energía, esto es, ![]() . Cuando se consideran fotones de muy alta energía, con
longitudes de onda asociadas l < 1 Å (radiación X), puede
emplearse para el cálculo la fórmula de Klein-Nishina
(Heitler 1954), la cual predice un coeficiente algo menor que el indicado en
(10.67). En la práctica, puede sin embargo ignorarse esta diferencia en las
fotosferas estelares.
. Cuando se consideran fotones de muy alta energía, con
longitudes de onda asociadas l < 1 Å (radiación X), puede
emplearse para el cálculo la fórmula de Klein-Nishina
(Heitler 1954), la cual predice un coeficiente algo menor que el indicado en
(10.67). En la práctica, puede sin embargo ignorarse esta diferencia en las
fotosferas estelares.
Si bien, en principio, puede ocurrir scattering por núcleos atómicos, este proceso resulta despreciable
en virtud de que el cociente 1/m2
en (10.66) es demasiado pequeño. En el caso más general el scattering por
electrones no es isotrópico, sino que existen direcciones preferenciales para
la dispersión (anisotropía intrínseca del proceso). Sin embargo, en una
fotosfera estelar, en promedio, la dispersión por electrones es o se considera
isotrópica.
Dado que este mecanismo de absorción aparente resulta
importante en atmósferas a elevadas temperaturas donde abundan los electrones
libres, suele expresarse este coeficiente de absorción en cm2 por partícula
de H - en lugar de cm2 por átomo de H neutro - de la siguiente
manera :
![]() , (10.68)
, (10.68)
en la cual ![]() representa el
cociente entre la densidad electrónica y la densidad de partículas de H (átomos
de HI + protones), Pe es
la presión electrónica y PH
la presión parcial debida al H.
representa el
cociente entre la densidad electrónica y la densidad de partículas de H (átomos
de HI + protones), Pe es
la presión electrónica y PH
la presión parcial debida al H.
¿ Qué relación existe entre la presión ![]() y la presión del gas
y la presión del gas ![]() ? Nótese que la
fotosfera de una estrella contiene otros elementos químicos además del H. Si N representa la densidad total de
partículas, entonces :
? Nótese que la
fotosfera de una estrella contiene otros elementos químicos además del H. Si N representa la densidad total de
partículas, entonces :
![]() , (10.69)
, (10.69)
en la cual ![]() es la densidad de
partículas del tipo i y
es la densidad de
partículas del tipo i y ![]() la densidad
electrónica. De acuerdo a (10.1), definimos la abundancia
la densidad
electrónica. De acuerdo a (10.1), definimos la abundancia ![]() relativa al hidrógeno
(por número de partículas) como :
relativa al hidrógeno
(por número de partículas) como :
![]() (10.70)
(10.70)
De (10.69) y
(10.70) resulta:
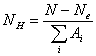 (10.71)
(10.71)
Multiplicando ambos miembros por ![]() se obtiene la
relación buscada :
se obtiene la
relación buscada :
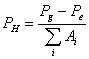 , (10.72)
, (10.72)
en la cual ![]() es la presión del
gas. Reemplazando (10.72) en (10.68) resulta :
es la presión del
gas. Reemplazando (10.72) en (10.68) resulta :
 , (10.73)
, (10.73)
en la cual como hemos visto ![]() está expresado en cm2 por partícula de H.
está expresado en cm2 por partícula de H.
Resulta evidente que la
emisión estimulada no debe ser incluída en este caso, ya que estamos
considerando un proceso de absorción aparente, no real. Nótese además que el scattering Thompson es un caso
particular del efecto Compton, ya que
si se consideran fotones con bajas energías en relación a la energía en reposo
de los electrones, no ocurre prácticamente cambio alguno en la frecuencia del
fotón dispersado. A medida que aumenta la energía del fotón, aumenta el
enrojecimiento del mismo por efecto
Compton.
Para tener una idea de la cantidad en la que puede
contribuir la dispersión electrónica a la opacidad continua, debe tenerse
presente que en las estrellas de la secuencia principal (clase de luminosidad
V), la presión del gas ![]() es aproximadamente
del mismo orden que la presión del H y ambas tienen valores entre 103 y
105 dinas/cm2.
Si se tiene en cuenta (10.68), estos valores implican
es aproximadamente
del mismo orden que la presión del H y ambas tienen valores entre 103 y
105 dinas/cm2.
Si se tiene en cuenta (10.68), estos valores implican ![]() por partícula de H,
cantidad ésta muy pequeña comparada con los otros procesos de absorción. Por el
contrario, en las estrellas supergigantes (clase de luminosidad I), la presión
del gas
por partícula de H,
cantidad ésta muy pequeña comparada con los otros procesos de absorción. Por el
contrario, en las estrellas supergigantes (clase de luminosidad I), la presión
del gas ![]() oscila entre 10 y 100
dinas/cm2, de manera que
el coeficiente
oscila entre 10 y 100
dinas/cm2, de manera que
el coeficiente ![]() por unidad de presión
electrónica resulta entre dos y tres órdenes de magnitud mayor.
por unidad de presión
electrónica resulta entre dos y tres órdenes de magnitud mayor.
Si se desea obtener el coeficiente de absorción por
dispersión electrónica expresado en cm2 por gramo de materia estelar, basta
multiplicar el coeficiente ![]() (expresado en cm2 por electrón) por el cociente
(expresado en cm2 por electrón) por el cociente ![]() , estando la densidad r expresada en gr/cm3. Es decir, de acuerdo a la notación adoptada en
la Sección 10.3, se tendrá :
, estando la densidad r expresada en gr/cm3. Es decir, de acuerdo a la notación adoptada en
la Sección 10.3, se tendrá :
![]() , (10.74)
, (10.74)
en donde ahora ![]() está expresado en cm2 por gramo de materia estelar.
está expresado en cm2 por gramo de materia estelar.
En la fotosfera solar (T » 6000 oK,
Q = 0.84), el
cociente entre la densidad electrónica y la densidad de átomos de H neutro es
aproximadamente similar al cociente entre entre la presión electrónica y la
presión del gas. El valor de este cociente es del orden de 3x10-3.
Si se compara este valor con el obtenido antes en (10.52), se advierte que en
la fotosfera solar son mucho más abundantes los electrones libres que los iones
![]() . Sin embargo, dado que el coeficiente por dispersión
electrónica es tan bajo comparado con los correspondientes coeficientes de
absorción por átomo de H neutro o por ión
. Sin embargo, dado que el coeficiente por dispersión
electrónica es tan bajo comparado con los correspondientes coeficientes de
absorción por átomo de H neutro o por ión ![]() , la contribución de la dispersión electrónica a la opacidad
continua en el Sol es absolutamente despreciable.
, la contribución de la dispersión electrónica a la opacidad
continua en el Sol es absolutamente despreciable.
10.13
DISPERSIÓN RAYLEIGH
El término dispersión
o scattering Rayleigh se refiere a la dispersión de la radiación producida
por sistemas ligados, tales como átomos o moléculas. Este caso es esencialmente
idéntico a la dispersión electrónica, sólo que la dispersión Rayleigh es
producida por partículas de tamaños mucho mayores que los electrones. De allí
que este tipo de scattering sea importante en las atmósferas de estrellas de
temperaturas moderadamente bajas (tipos G, K y M) donde abundan átomos neutros
e incluso compuestos moleculares.
La expresión del coeficiente de absorción debido a dispersión Rayleigh, expresado en cm2 por gramo de
materia estelar y para un átomo de H es :
![]() , (10.75)
, (10.75)
en la cual ![]() es el coeficiente de
absorción por dispersión electrónica expresado en cm2 por gramo de
materia estelar y donde lL = 1026 Å es un promedio pesado de las longitudes de
onda de las líneas de la serie de Lyman. La comparación de la longitud de onda
incidente l con lL se debe a que a bajas
temperaturas prácticamente todos los átomos de H están en el nivel fundamental
y, por lo tanto, se encuentran en condiciones de absorber las líneas de la
serie de Balmer. Una deducción simplificada de (10.75) puede verse en
Böhm-Vitense (1997).
es el coeficiente de
absorción por dispersión electrónica expresado en cm2 por gramo de
materia estelar y donde lL = 1026 Å es un promedio pesado de las longitudes de
onda de las líneas de la serie de Lyman. La comparación de la longitud de onda
incidente l con lL se debe a que a bajas
temperaturas prácticamente todos los átomos de H están en el nivel fundamental
y, por lo tanto, se encuentran en condiciones de absorber las líneas de la
serie de Balmer. Una deducción simplificada de (10.75) puede verse en
Böhm-Vitense (1997).
Es importante notar que la dispersión Rayleigh aumenta
con ![]() , de manera que los fotones ultravioletas resultan más
dispersados que los fotones de la región visible. El color azul del firmamento
es esencialmente debido a que la radiación solar sufre dispersión Rayleigh
producida por las moléculas de la atmósfera terrestre. La dispersión Rayleigh
debida a átomos de H neutro, contribuye a la absorción continua a temperaturas
comparativamente bajas y en la región del ultravioleta. A temperaturas aún más
bajas (estrellas M) el scattering Rayleigh molecular, particularmente debido a
moléculas H2, prevalece sobre el scattering Rayleigh atómico. Al
igual que el scattering electrónico, la dispersión Rayleigh constituye un
fenómeno de absorción aparente, motivo por el cual tampoco habrá que corregir
por el factor de emisiones estimuladas.
, de manera que los fotones ultravioletas resultan más
dispersados que los fotones de la región visible. El color azul del firmamento
es esencialmente debido a que la radiación solar sufre dispersión Rayleigh
producida por las moléculas de la atmósfera terrestre. La dispersión Rayleigh
debida a átomos de H neutro, contribuye a la absorción continua a temperaturas
comparativamente bajas y en la región del ultravioleta. A temperaturas aún más
bajas (estrellas M) el scattering Rayleigh molecular, particularmente debido a
moléculas H2, prevalece sobre el scattering Rayleigh atómico. Al
igual que el scattering electrónico, la dispersión Rayleigh constituye un
fenómeno de absorción aparente, motivo por el cual tampoco habrá que corregir
por el factor de emisiones estimuladas.
Conforme a lo
expresado en la sección anterior, en la fotosfera solar hay aproximadamente
3x103 veces más átomos de H neutros que electrones libres. En
consecuencia, la dispersión Rayleigh debida a esta clase de átomos solamente
deja de ser despreciable. Para l << 3000 Å, sin embargo, los
coeficientes de absorción de los metales son por lo general mayores que el
correspondiente al scattering Rayleigh.
10.14
EL COEFICIENTE DE ABSORCIÓN CONTINUA TOTAL
En la Sección 10.2 hicimos referencia a que la absorción
continua observada en una determinada frecuencia en un espectro estelar,
resulta de sumar las absorciones (verdaderas y aparentes) producidas en esa
frecuencia por determinados procesos físicos (transiciones ligado-libre,
libre-libre, dispersión de la radiación, etc), los cuales involucran diferentes
elementos químicos en sus respectivos estados de excitación y/o ionización.
Vimos además en la Sección 10.5 que las absorciones verdaderas deben ser
corregidas por el factor de emisiones estimuladas ![]() . Por lo tanto, el coeficiente
de absorción continua total debe obtenerse sumando todos los coeficientes
de absorción mencionados en este capítulo, corrigiendo por emisión estimulada
en los casos que corresponda.
. Por lo tanto, el coeficiente
de absorción continua total debe obtenerse sumando todos los coeficientes
de absorción mencionados en este capítulo, corrigiendo por emisión estimulada
en los casos que corresponda.
Cuando se consideren los absorbedores continuos
hidrogenoides (H, ión ![]() , H2,
etc), hay que tener en cuenta que el coeficiente
, H2,
etc), hay que tener en cuenta que el coeficiente ![]() dado en (10.61) ya ha
sido corregido por emisiones estimuladas. Luego, el coeficiente k(H)
total correspondiente a los absorbedores continuos hidrogenoides, expresado
en cm2 por átomo de H neutro, será :
dado en (10.61) ya ha
sido corregido por emisiones estimuladas. Luego, el coeficiente k(H)
total correspondiente a los absorbedores continuos hidrogenoides, expresado
en cm2 por átomo de H neutro, será :
![]() , (10.76)
, (10.76)
en la cual ![]() es el factor de
emisiones estimuladas.
es el factor de
emisiones estimuladas.
Si a elevadas
temperaturas se desea tener en cuenta la ionización del H, es conveniente
expresar k(H) en cm2 por partícula de H y no por átomo de H
neutro. Una partícula de hidrógeno es o bien un átomo de H neutro o bien un
átomo de H ionizado (protón). Si se multiplica (10.76) por el cociente entre el
número de átomos de H neutro (HI) respecto del número de partículas de
hidrógeno (HI + HII), el coeficiente k(H) resultará expresado en
cm2 por partícula de H. La expresión (4.16) aplicada al H es :
![]() , (10.77)
, (10.77)
en la cual HII y HI
representan las densidades de átomos de H ionizados (protones) y átomos de H
neutros, respectivamente. A su vez, (10.77) equivale a :
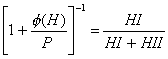 (10.78)
(10.78)
Luego, el coeficiente de absorción continua k(H) total, expresado en cm2 por partícula de H, es :
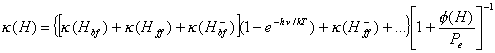 (10.79)
(10.79)
Finalmente, el coeficiente k de absorción continua total, expresado en cm2 por partícula de H, será
:
![]() , (10.80)
, (10.80)
en la cual cada uno de los
términos que se han agregado en esta expresión deben expresarse en cm2 por partícula de H.
La transformación del coeficiente k total, expresado en cm2 por partícula de H, al coeficiente kn total, expresado en cm2 por gramo de materia estelar, se logra dividiendo k por la cantidad de de gramos por partícula de H existente en la fotosfera. En efecto, en
este caso se tiene :
![]() (10.81)
(10.81)
¿ Cómo puede expresarse la cantidad de gramos (masa) por
partícula de H en la fotosfera de una estrella ? Conforme a lo expresado en la
Sección 1.1, la masa ![]() (en gramos) de un
átomo correspondiente al elemento i
en la fotosfera, es el cociente entre el peso atómico
(en gramos) de un
átomo correspondiente al elemento i
en la fotosfera, es el cociente entre el peso atómico ![]() (expresado en gramos)
del elemento i y el número de
Avogradro N0 = 6.0225x1023.
:
(expresado en gramos)
del elemento i y el número de
Avogradro N0 = 6.0225x1023.
:
![]() (10.82)
(10.82)
Si la
abundancia del elemento i, respecto
del hidrógeno, es ![]() y está dada por
(10.70), entonces la cantidad de gramos por partícula de H será simplemente :
y está dada por
(10.70), entonces la cantidad de gramos por partícula de H será simplemente : ![]() .
.
Para expresar
el coeficiente de absorción continua total en cm2 por gramo de
materia estelar debemos pues conocer las abundancias relativas ![]() de los diversos
elementos químicos que componen la fotosfera. Un valor típico para una
atmósfera normal es :
de los diversos
elementos químicos que componen la fotosfera. Un valor típico para una
atmósfera normal es : ![]() = 2x10-24 gramos
por partícula de H.
= 2x10-24 gramos
por partícula de H.