LEY DE MAXWELL DE
DISTRIBUCIÓN DE VELOCIDADES
En condiciones de equilibrio
termodinámico las velocidades de las partículas en un gas obedecen la Ley de Maxwell de distribución de
velocidades, también conocida como Ley de distribución de velocidades de Maxwell
y Boltzmann. De acuerdo a esta ley, el número de partículas con componentes de
velocidad en la dirección del eje x
comprendidas entre nx y nx+dnx , es :
![]() ,
(4.20)
,
(4.20)
![]()
en la cual N es el número total de partículas del
gas y m la masa de una partícula.
Introduciendo la variable a, definida de la siguiente manera :
![]() , (4.21)
, (4.21)
resulta :
![]() (4.22)
(4.22)
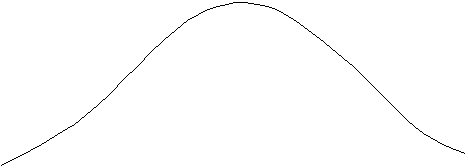
La (4.22) es una función Gaussiana. En efecto, si se grafica N (nx) en términos de nx para el caso del gas hidrógeno a T = 6.000 °K y T = 24.000 °K, por ejemplo, se obtienen las gaussianas de la Figura 4-3.
Análogamente, las fracciones de partículas del gas con velocidades
en la dirección de los ejes y y z, y en los rangos vy, vy+dvy y vz+dvz , se
escriben como :
![]() (4.23)
(4.23)
![]() (4.24)
(4.24)
Por lo tanto, la fracción de partículas del gas con componentes de velocidad en el rango vx,vx+dvx , vy, vy+dvy , vz , vy+dvz , es :
![]() (4.25)
(4.25)
Para lograr que la (4.25) tenga un significado más intuitivo,
podemos introducir la función N(vx , vy , vz),
la cual representa el número de partículas con componentes entre vx y vx + dvx, vy y vy + dvy, y vz y vz + dvz . Luego :
![]() (4.26)
(4.26)
En muchas
ocasiones resulta de interés considerar los módulos de las velocidades de las
partículas, en lugar de sus componentes de velocidad. En este caso, no interesa
conocer la dirección en la cual se mueve una determinada partícula. En la Figura (4-4) todas las partículas con
vectores velocidad ![]() desde el origen hasta
un punto de la esfera verifican la ecuación :
desde el origen hasta
un punto de la esfera verifican la ecuación :
![]() ,
,
en la cual v es el módulo
del vector velocidad.
![]()
Figura 4-3: Número de
partículas con velocidades vx
en la dirección del eje x, en
función de vx para dos
temperaturas absolutas.
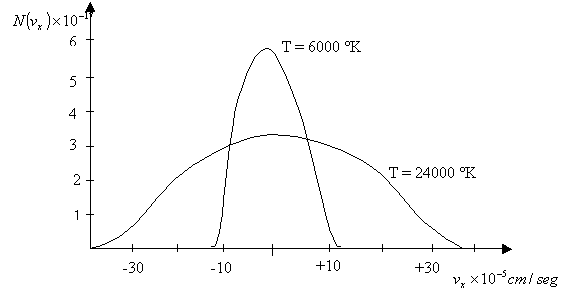
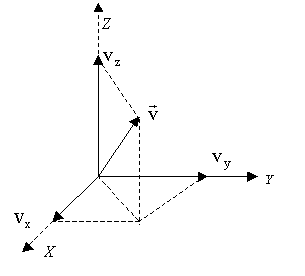
Figura 4-4. El vector velocidad y sus componentes.
En lugar de considerar un elemento de volumen rectangular dvxdvydvz
en (4.26), vamos ahora a considerar el
elemento de volumen comprendido entre las dos capas esféricas de radios v y v+dv.
Dicho elemento es 4pv2 dv, de manera que la
expresión (4.26) queda:
![]() (4.27)
(4.27)
![]() (4.28)
(4.28)
Esta última puede reescribirse de la
siguiente manera :
![]() (4.29)
(4.29)
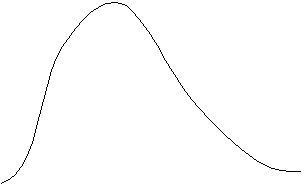
La distribución de velocidades (módulos) explicitada en (4.27), (4.28) o (4.29), se muestra en la Figura 4-5 para el caso del gas hidrógeno. En la misma se presentan dos curvas, o bien dos distribuciones Maxwellianas de velocidades correspondientes al hidrógeno a temperaturas de 6.000 °K y 24.000 °K, respectivamente.
Si definimos como velocidad
más probable vp al
valor de la velocidad que hace máxima la distribución maxwelliana de
velocidades (4.27), es fácil mostrar que la constante a coincide con vp. En efecto, derivando e igualando a cero la (4.27)
resulta :
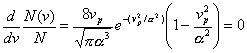
O bien :
![]() (4.30)
(4.30)
de la cual se obtiene:
vp = a
(4.31)
Hemos demostrado que la constante a
representa la velocidad más probable de las partículas. Por definición, la velocidad media ![]() (velocidad promedio)
de las partículas es :
(velocidad promedio)
de las partículas es :
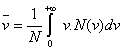 (4.32)
(4.32)
Puede demostrarse fácilmente que esta integral es :![]() . Luego, la velocidad media
. Luego, la velocidad media ![]() se relaciona con vp de la siguiente manera :
se relaciona con vp de la siguiente manera :
![]() (4.33)
(4.33)
¿ Qué significa la velocidad
cuadrática media de las partículas del gas ? Por definición esta velocidad
debe verificar la siguiente relación :
![]() (4.34)
(4.34)
La velocidad cuadrática media es pues un promedio tomado con respecto
a la energía. Recordando que vp
= a, las expresiones (4.21) y
(4.34) nos permiten obtener la siguiente relación simple entre la
velocidad cuadrática media y la velocidad más probable :
![]() =
=![]() (4.35)
(4.35)
A manera de ejemplo, podemos determinar las velocidades vp ,![]() y
y ![]() para moléculas de
oxígeno a 273 °K de temperatura. Puesto que la masa de la molécula de oxígeno
es 32x1.66x10-24 gr,
haciendo los cálculos resulta :
para moléculas de
oxígeno a 273 °K de temperatura. Puesto que la masa de la molécula de oxígeno
es 32x1.66x10-24 gr,
haciendo los cálculos resulta :
vp = 3.76x104 cm/seg
![]()
![]()
La velocidad cuadrática media es entonces la mayor, siguiendo en orden decreciente la velocidad media y luego la velocidad más probable.
![]()
40 30 20 10 N(
12 10 8 6 4 2 0![]()
![]()
![]() )x10-7
)x10-7
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
T =
6000°K °K <V>> Vp
![]()
![]()
![]()
T = 24000 °K n
Figura 4-5:
Número de partículas con módulos de velocidad total v
en función de v, para
dos temperaturas absolutas.