7 LEY DE DISOCIACIÓN MOLECULAR
Es bien sabido que las leyes de excitación de Boltzmann y de ionización de Saha permiten describir, al menos cualitativamente, los espectros atómicos de la secuencia de Harvard. Análogamente, existe una ley conocida como de ley de disociación molecular, que permite explicar los espectros moleculares de las estrellas más frías de dicha secuencia. Esta ley, cuya derivación escapa al alcance de esta obra, tiene la siguiente forma :
![]() , (4.36)
, (4.36)
donde n(A)
y n(B) representan los números de átomos A y B respectivamente; n(AB)
es el número de moléculas formadas por un átomo del tipo A y otro del tipo B, y K'(AB)
suele denominarse constante de
disociación correspondiente a la molécula AB. Esta constante puede calcularse para cada molécula en
particular.
Si bien no es nuestro propósito describir el cálculo de K'(AB), puede resultar de interés mencionar los parámetros que involucra su determinación. La constante de disociación K'(AB) admite la siguiente expresión analítica :
![]() ,
(4.37)
,
(4.37)
en la cual pA, pB y pAB representan las presiones parciales producidas por
los átomos A, B y las moléculas AB,
respectivamente, UAB es la
función de partición interna de la molécula, UA y UB
son las funciones de partición de los átomos A y B respectivamente, M es la masa reducida de la molécula y D el potencial de disociación.
La función de partición interna de la molécula puede expresarse como la sumatoria sobre los distintos niveles de energía de la molécula, del producto de tres términos, cada uno de los cuales representa un tipo de energía determinado en la molécula. O sea que :
UAB = Urot . Uvib . Uel
,
(4.38)
donde Urot representa la energía
rotacional, Uvib la
vibracional y Uel la
electrónica.
A la expresión anterior se le debe agregar un factor 1 o 1/2 según que la molécula diatómica posea dos átomos de distinta especie o átomos iguales, respectivamente.
En una primera aproximación la función Urot puede expresarse de la siguiente manera :
![]() , (4.39)
, (4.39)
donde B es h/8p2 Ic, siendo I el momento de inercia de la molécula.
Por otra parte, la función Uvib
admite la siguiente expresión aproximada :
![]() , (4.40)
, (4.40)
en la cual n es la frecuencia de vibración de la molécula.
El término correspondiente a los distintos estados electrónicos Uel puede reemplazarse por el
peso estadístico gAB del
nivel fundamental de la molécula, debido a las bajas temperaturas a las cuales
pueden existir las moléculas. Finalmente, las funciones de partición UA y UB pueden también igualarse a los pesos estadísticos g(A)
y g(B) de los niveles fundamentales
de los átomos A y B, respectivamente.
Si se reemplaza en (4.38) las expresiones (4.39) y (4.40) y se tienen en cuenta las aproximaciones hechas para las funciones de partición, la constante de disociación resulta:
![]()
Reemplazando el parámetro B por su expresión en función del momento de inercia I y agrupando se obtiene :
![]() ,
,
donde ![]() .
.
Las constantes de disociación K’(AB) han sido calculadas para muchas moléculas de interés astrofísico. Los cálculos de equilibrio de disociación se realizan teniendo en cuenta que a la abundancia total de un determinado elemento químico en la atmósfera de una estrella contribuyen, por un lado, los átomos libres del elemento en cuestión y, por otro, los átomos de dicho elemento ligados a otros átomos de la misma o distinta especie (moléculas presentes en la atmósfera).
Si consideramos el caso particular del elemento nitrógeno, tendremos que el número total de átomos de dicho
elemento en la atmósfera considerada será :
n’(N) = n(N) + 2n(N)
+ n(CN) + n(CO) + ...
(4.41)
Para el caso del carbono,
la expresión anterior debería escribirse de la siguiente manera :
n’(C) = n(C) + 2n(C2) + n(CN) + ... (4.42)
Ecuaciones similares a las anteriores podrían escribirse para los restantes elementos químicos presentes en la atmósfera. Las cantidades n’(N), n’(C), etc. se conocen en forma relativa a partir de las abundancias químicas adoptadas para la atmósfera que se está considerando. Para calcular los segundos miembros de las expresiones anteriores podemos escribir dichas expresiones en función de las presiones parciales, teniendo en cuenta la definición de constante de disociación explicitada en (4-36). Así resultan para el nitrógeno y para el carbono las siguientes expresiones :
![]()
![]()
![]()
Si se extrae el factor común en las expresiones anteriores, resultan :
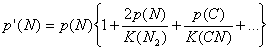
![]()
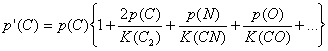
Puesto que p’ y K se conocen, la resolución simultánea de estas ecuaciones permite obtener las cantidades p(C), p(N), etc.
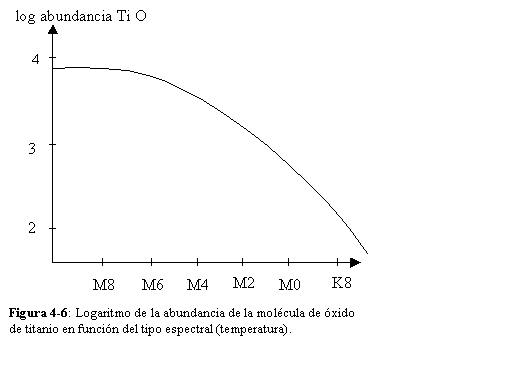
Como ejemplo de los resultados que se obtienen, la Figura (4-6) muestra el logaritmo de la abundancia de óxido de titanio en función del tipo espectral (temperatura).