3 ECUACIÓN DE EQUILIBRIO DE IONIZACIÓN DE SAHA
Saha demostró que el número Ni+1
de átomos en el estado de ionización (i+1)
respecto del número Ni en
el estado de ionización i, está dado
por :
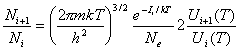 , (4.12)
, (4.12)
en la cual Ne es el número de electrones libres por unidad de volumen e Ii el potencial de ionización
del estado de ionización i. La ecuación de equilibrio de ionización de Saha
(4.12) expresa que la frecuencia con la cual los iones en el estado de
ionización i se ionizan una vez y
pasan al estado (i+1), es igual a la
frecuencia con la cual los iones en el estado de ionización (i+1) se recombinan con electrones libres
para formar iones en el estado i. Es
decir, la frecuencia de ionizaciones y recombinaciones es la misma (equilibrio
termodinámico). Sustituyendo los valores numéricos de las constantes y tomando
logaritmos en (4.12) resulta :
![]() (4.13)
(4.13)
en la cual los
factores numéricos son tales que, al igual que antes, la temperatura debe
medirse en grados Kelvin y el potencial de ionización en eV, mientras que Ne representa electrones por centímetro cúbico.
Una forma alternativa de la ecuación de Saha se obtiene
introduciendo en (4.13) la presión electrónica Pe. Puesto que Pe
= NekT, resulta :
![]() (4.14)
(4.14)
Para el átomo de hidrógeno neutro y una vez ionizado las funciones de
partición valen: U1 = 2 y U2 = 1, respectivamente.
Luego, para el mencionado átomo a 5.000 °K, 15.000 °K y 25.000 °K, se obtienen
de (4.14) los valores indicados en la Tabla
4-2.
TABLA 4-2
T 5000 °K 15000 °K 25000 °K
![]() 1.1x10-5
2.4x105 5.9x107
1.1x10-5
2.4x105 5.9x107
A 15.000 °K y aún para presiones electrónicas bajas, el hidrógeno está casi completamente ionizado.
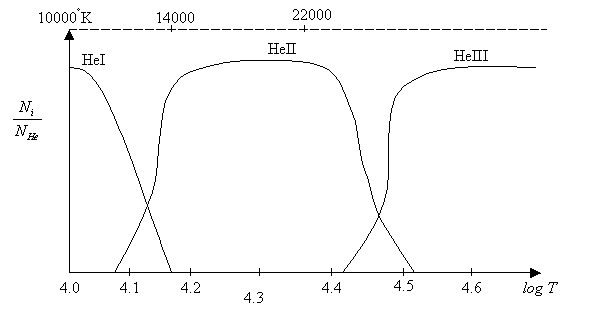
A partir de la ecuación de Saha y usando Pe = 1 se obtiene
una idea de cómo varía la fracción de átomos de HeI, HeII y HeIII respecto del número total de
átomos de helio, en función de la temperatura (Figura 4-2).
Para temperaturas menores que 10.000 °K prácticamente todo el helio se encuentra en estado neutro. Entre 10.000 °K y 14.000 °K casi todo este elemento se halla una vez ionizado, permaneciendo en este estado hasta aproximadamente 22.000 °K. Más allá de esta temperatura comienza a formarse HeIII y a partir de los 30.000 °K prácticamente todo el helio está ionizado.
Figura
4.2 : Variación del número de átomos de He I, He II y He III con respecto
al número total de átomos de helio, en función del logaritmo de la
temperatura.
La ecuación (4.14) se usa ligeramente diferente para el cálculo de la siguiente manera :
![]() , (4.15)
, (4.15)
en la cual ![]() y N1 representan el número de
átomos neutros y una vez ionizados, por unidad de volumen, respectivamente. En
forma concisa, la expresión (4.15) se escribe :
y N1 representan el número de
átomos neutros y una vez ionizados, por unidad de volumen, respectivamente. En
forma concisa, la expresión (4.15) se escribe :
![]() , (4.16)
, (4.16)
en la cual f(T) es una función de la temperatura que
verifica :

(4.17)
![]()
siendo q = 5040/T.
Para escribir N2/N1 por ejemplo, se procede de la misma manera. El parámetro ![]() en (4.17) es el
potencial de ionización del correspondiente ion.
en (4.17) es el
potencial de ionización del correspondiente ion.