




Próxima: Pressão Mecânica
Volta: Interiores Estelares
Anterior: Interiores Estelares
O Sol
| Massa |
M⊙ = 1,9884×1030 kg |
| Raio |
R⊙ = 695 500 km = 109 RTerra |
| Densidade média |
ρ = 1409 kg/m3
|
| Densidade central |
ρc= 160 000 kg/m3 |
| Distância |
1 UA =
149 600 000 km |
| Luminosidade |
L⊙=3,828×1026 watts=3,828×1033 ergs/s |
| Luminosidade em neutrinos |
Lν⊙≃0,023 L⊙ |
| Temperatura efetiva |
Tef⊙ = 5785 K |
| Temperatura central |
Tc⊙ = 15 000 000 K
|
| Magnitude absoluta bolométrica |
Mbol⊙ = 4,72 |
| Magnitude absoluta visual |
MV⊙ = 4,79 |
| Tipo espectral e classe de luminosidade |
G2 V |
| Índices de cor |
B-V=0,62 |
| |
U-B=0,10 |
| Composição química principal (No) |
Hidrogênio = 91,2 % |
| |
Hélio = 8,7% |
| |
Oxigênio = 0,078 % |
| |
Carbono = 0,043 % |
| Período rotacional no equador |
25,67 d |
| na latitude 45° |
27,50 d |
| na latitude 75° |
33,40 d |
Equação de Estado
Uma equação de estado é uma equação termodinâmica relacionando os parâmetros da matéria, como temperatura,
pressão, densidade e energia interna. Não existe uma única equação de estado que descreva as propriedades
sob todas as condições. Uma equação de estado clássica é a equação do gás ideal, formulada historicamente
pelo inglês Robert Boyle (1627-1691) em 1662, que descreve adequadamente gases atômicos e moleculares. Para partículas elementares
precisamos levar em conta suas massas e spin, com a estatística de Fermi-Dirac, para spins semi-inteiros ou Bose-Einstein,
para spins inteiros.
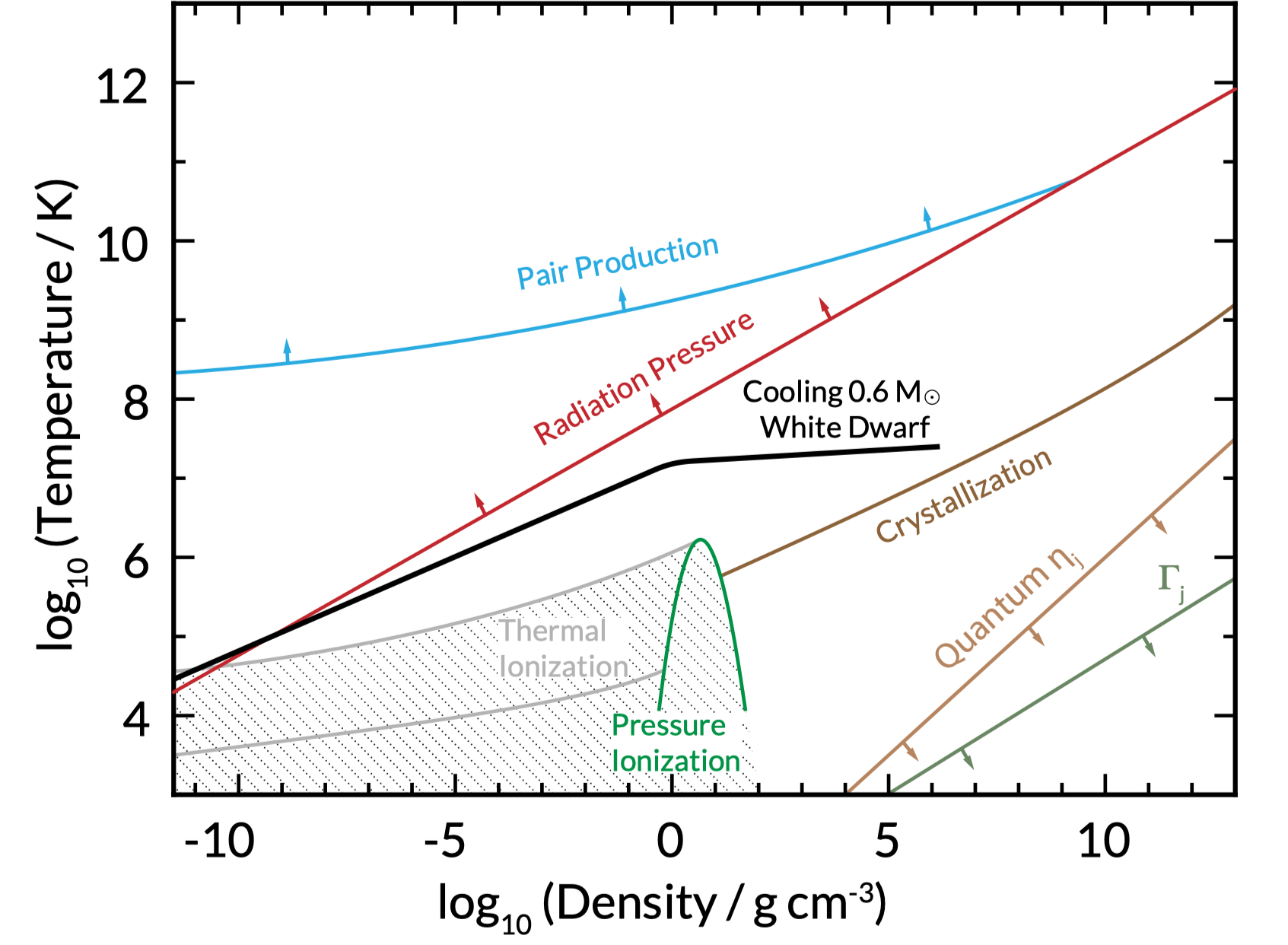 Tabelas para matéria ionizada para uso em modelos, incluindo escudamento eletrônico, cristalização, efeitos relativísticos para
10-12 g/cm3≥ρ≥1013 g/cm3 e 103 K≥ T ≥1013 K foram calculadas por
Adam S. Jermyn,
Josiah Schwab,
Evan Bauer,
Frank X. Timmes
& Alexander Y. Potekhin,
Skye: A Differentiable Equation of State, 2021, Astrophysical Journal, 913, id 72.
Tabelas para matéria ionizada para uso em modelos, incluindo escudamento eletrônico, cristalização, efeitos relativísticos para
10-12 g/cm3≥ρ≥1013 g/cm3 e 103 K≥ T ≥1013 K foram calculadas por
Adam S. Jermyn,
Josiah Schwab,
Evan Bauer,
Frank X. Timmes
& Alexander Y. Potekhin,
Skye: A Differentiable Equation of State, 2021, Astrophysical Journal, 913, id 72.
Temperatura
O conceito físico de
temperatura está associado ao
conceito de equilíbrio térmico, pois é uma medida da energia
cinética média das partículas. Um sistema mecânico
tem muitas configurações possíveis,
dependendo da distribuição de energia de seus subsistemas.
Dentre estas configurações, existe aquela mais
provável, em que todos os subsistemas estão em
equilíbrio térmico, e que pode ser calculada
com as técnicas da mecânica estatística de equilíbrio. Em equilíbrio térmico existe balanço detalhado:
todo processo microscópico é exatamente balançado
pelo processo inverso.
Como o assunto envolve resultados de
tratamento detalhados
de muitos campos da física, aqui simplesmente
citaremos os resultados, e justificaremos
com argumentos qualitativos, deixando a demonstração
para textos especializados.
Em um sistema clássico, as partículas se movem em
trajetórias definidas, de modo que podemos, em princípio,
distingüir entre as partículas, mesmo idênticas, isto
é, podemos colocar rótulos de partícula 1,
partícula 2, ...
Em uma descrição quântica isto não pode ser feito
porque o Princípio da Incerteza de Heisenberg,
que rendeu o prêmio Nobel em física de 1932
ao físico alemão Werner Karl Heisenberg (1901-1976),
não permite a contínua observação do movimento
das partículas, sem mudar o comportamento do sistema.
Isto é equivalente a dizer que, em mecânica quântica,
que descreve as partículas como ondas tridimensionais,
onde a função de onda associada a cada
partícula não é pontual e dá a probabilidade de se
encontrar a partícula em uma posição,
a superposição da função de
onda torna impossível a distinção entre as
partículas. Portanto, em uma descrição
quântica, as partículas idênticas são
indistingüíveis.
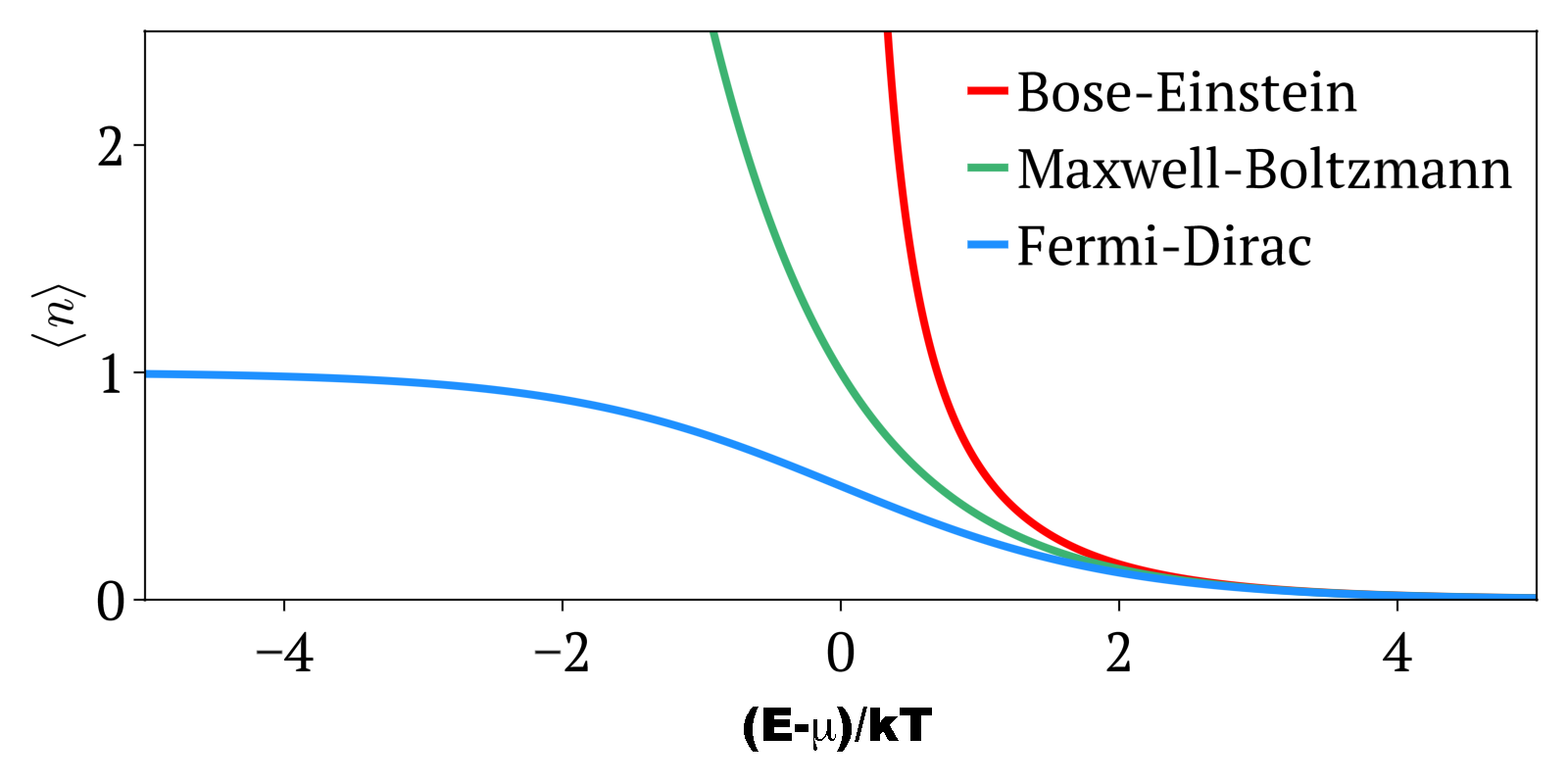
Partículas descritas por autofunções assimétricas
têm spin semi-inteiro, e são chamadas de férmions,
em honra ao físico ítalo-americano Enrico Fermi
(1901-1954), e estão sujeitas ao
Princípio da Exclusão,
elaborado pelo físico austríaco
Wolfgang Pauli (1900-1958), e que lhe rendeu o
prêmio Nobel em 1945: duas partículas
de mesmo spin não podem ocupar o mesmo estado quântico.
As partículas de Bose, ou bósons, em honra ao físico indiano
Satyendra Nath Bose (1894-1974), têm spin inteiro, e embora
indistingüíveis, não estão sujeitas ao
Princípio da Exclusão, porque têm autofunções
simétricas, que não se anula se todos
os números quânticos de duas ou mais partículas
forem idênticos.
Para um gás em equilíbrio, a configuração mais provável depende da natureza das
partículas do gás, que para partículas
elementares caem em três classes:
1) partículas idênticas mas distingüíveis,
que são as partículas clássicas;
2) partículas idênticas mas
indistingüíveis de spin semi-inteiro, por exemplo, elétrons, pósitrons, neutrinos, prótons,
nêutrons e mésons μ; e
3) partículas idênticas mais indistingüíveis de spin inteiro,
por exemplo fótons, mésons π
e partículas α
(He4).
Se o número de partículas com momentum p
é definido como n(p),
e o número de estados possíveis de momentum p
por g(p),
a configuração mais provável,
a função partição,
correspondendo a estes três casos pode ser derivada
pela mecânica estatística,
maximizando-se o número de maneiras de distribuir as partículas
nos níveis de energia disponíveis:
A energia E nas equações acima é a energia de cada partícula.
O parâmetro μ,
o potencial químico, definido como
[seção (1.4.1)]
onde s é a entropia e v o volume.
O potencial químico
é um multiplicador Lagrangeano
dependente da densidade
de partículas - a energia adicionada ao sistema quando uma partícula
é introduzida no sistema -, e é obtido através da normalização
onde N é a densidade total de partículas - número de partículas
por unidade de volume - e
onde Egás é a densidade de energia total do gás.
O conceito de potencial químico foi
introduzido pelo físico-químico americano
Josiah Willard Gibbs (1839-1903).
Estas fórmulas são
derivadas considerando-se as várias maneiras de se
arranjar um número fixo de partículas
em estados individuais de energia, de modo que
a energia total do gás seja conservada.
Na estatística de Fermi-Dirac, derivada por Enrico Fermi e
pelo inglês Paul Adrien Maurice Dirac (1902-1984),
para T=0, onde EF
é chamada de energia de Fermi, e depende fracamente
da temperatura. A Energia de Fermi é o valor da energia cinética para o estado mais alto ocupado pelos férmions
em um sistema.
Para um gás de fótons, que são bósons de massa
zero, μ=0,
porque o número de fótons não é conservado,
isto é, quanto maior é a temperatura - energia -, maior é
o número de fótons.
A densidade de estados livres, ou fator de degenerescência
g(p) pode ser derivada usando-se
o princípio da incerteza de Heisenberg
e o fato
de que para elétrons e para fótons podem
existir dois estados de polarização (spin),
e que o volume do espaço de momentum, para
o qual o vetor  tem magnitude constante p,
é simplesmente o volume da casca esférica,
4πp2dp:
para fótons e elétrons.
1.1
tem magnitude constante p,
é simplesmente o volume da casca esférica,
4πp2dp:
para fótons e elétrons.
1.1
Para temperatura zero,
 |
(1.4) |
onde h
é a constante de Planck, com valor
h=6,63×10-27 ergs s, e m
é a massa da partícula.
Todos os estados com  estão ocupados, e
todos os estados com
estão ocupados, e
todos os estados com  estão desocupados.
Esta relação pode ser derivada da equação (1.2),
já que, para T=0,
logo
e considerando que
para temperatura zero podemos usar a relação entre
momentum e velocidade não relativística (p=mv)
A relação entre a velocidade v
e o momentum p
depende de se
o gás é relativístico ou não. Para um gás
não relativístico (v≪c),
onde c
é a velocidade da
luz,
v=p/m.
Para um gás relativístico,
onde Epart
é a energia da partícula e mo
é sua massa de repouso.
estão desocupados.
Esta relação pode ser derivada da equação (1.2),
já que, para T=0,
logo
e considerando que
para temperatura zero podemos usar a relação entre
momentum e velocidade não relativística (p=mv)
A relação entre a velocidade v
e o momentum p
depende de se
o gás é relativístico ou não. Para um gás
não relativístico (v≪c),
onde c
é a velocidade da
luz,
v=p/m.
Para um gás relativístico,
onde Epart
é a energia da partícula e mo
é sua massa de repouso.
A densidade de energia do gás, isto é, energia por unidade de volume,
será então dada por:
 |
(1.5) |
onde E(p) é a energia de cada partícula, como função do momentum.
O número de maneiras possíveis de configurar partículas idênticas em g estados
é g!, e a aproximação de Stirling [James Stirling (1692-1770)]
permite escrever o fatorial, para um
grande número de estados, em termos de uma exponencial.
O erro relativo é menor que 1% para cerca de 1000 partículas.





Próxima: Pressão Mecânica
Volta: Interiores Estelares
Anterior: Interiores Estelares
©











![v \equiv \frac{\partial E_{part}}{\partial p}= \frac{p/m_0}{[1+(p/m_0c)^2]^{\frac{1}{2}}](img37.gif)
