| Níveis do hidrogênio | Classificação Espectral | Classes de Luminosidade | Lei de Boltzmann |

À intensidade da luz em diferentes comprimentos de onda, chamamos de espectro. Quase toda informação sobre as propriedades físicas das estrelas são obtidas direta ou indiretamente de seus espectros, principalmente suas temperaturas, densidades e composições.
O físico inglês Isaac Newton (1643-1727) demonstrou em 1665-66 que a luz branca, como a luz do Sol, ao passar por um prisma se decompõe em luz de diferentes cores, formando um espectro como o arco-íris.
 Em 1802, o médico, químico e físico inglês
William Hyde Wollaston (1766-1828)
usava o índice de refração da luz atravessando uma substância
para testar a pureza dos óleos e outras substâncias. Ele observou que,
passando a luz solar por uma fenda e depois por um prisma,
apareciam algumas linhas escuras no espectro, que ele interpretou
erroneamente como o limite das cores
(A method
of examining refractive and dispersive powers, by prismatic reflection,
Philosophical Transactions of the Royal Society, 92: 365-380).
Ele desenvolveu um método comercialmente viável
para separar a platina do minério, descobriu o paládio - um metal branco como a platina - em 1802
e o ródio, também um metal do grupo da platina, em 1804,
e inventou o prisma de Wollaston,
com dois prismas de calcita ortogonais, que separam a luz polarizada em dois feixes com polarizações ortogonais, usado em
polarimetria.
As linhas são
imagens da fenda
do espectrógrafo em diferentes comprimentos de onda.
Em 1802, o médico, químico e físico inglês
William Hyde Wollaston (1766-1828)
usava o índice de refração da luz atravessando uma substância
para testar a pureza dos óleos e outras substâncias. Ele observou que,
passando a luz solar por uma fenda e depois por um prisma,
apareciam algumas linhas escuras no espectro, que ele interpretou
erroneamente como o limite das cores
(A method
of examining refractive and dispersive powers, by prismatic reflection,
Philosophical Transactions of the Royal Society, 92: 365-380).
Ele desenvolveu um método comercialmente viável
para separar a platina do minério, descobriu o paládio - um metal branco como a platina - em 1802
e o ródio, também um metal do grupo da platina, em 1804,
e inventou o prisma de Wollaston,
com dois prismas de calcita ortogonais, que separam a luz polarizada em dois feixes com polarizações ortogonais, usado em
polarimetria.
As linhas são
imagens da fenda
do espectrógrafo em diferentes comprimentos de onda.
 Até 1820, o fabricante de intrumentos de vidro
- lentes, prismas, microscópios e telescópios -
alemão
Joseph Ritter von Fraunhofer (Frauenhofer)
(1787-1826), de Munique, inventor do espectroscópio, já havia
contado 574 linhas escuras
no espectro solar, chamadas depois de linhas de Fraunhofer.
Para 324 destas linhas, Fraunhofer deu o nome de letras maiúsculas:
A, B, C ...
para as linhas mais fortes e minúsculas para as mais fracas,
começando com A no vermelho.
Até 1820, o fabricante de intrumentos de vidro
- lentes, prismas, microscópios e telescópios -
alemão
Joseph Ritter von Fraunhofer (Frauenhofer)
(1787-1826), de Munique, inventor do espectroscópio, já havia
contado 574 linhas escuras
no espectro solar, chamadas depois de linhas de Fraunhofer.
Para 324 destas linhas, Fraunhofer deu o nome de letras maiúsculas:
A, B, C ...
para as linhas mais fortes e minúsculas para as mais fracas,
começando com A no vermelho.

Como veremos a seguir, 40 anos depois as linhas foram identificadas por Gustav Robert Kirchhoff (1824-1887) como sendo:
| Linha | λ(Å) | Elemento | Cor |
|---|---|---|---|
| A | 7594 | oxigênio | Vermelho |
| B | 6867 | oxigênio | |
| C | 6563 | hidrogênio, Hα | |
| D1 | 5896 | sódio | Amarelo |
D2 |
5890 | sódio | |
D3 |
5876 | hélio | |
E |
5270 | ferro e cálcio | |
| b1 | 5184 | magnésio | |
F |
4861 | hidrogênio, Hβ | Verde |
| G | 4308 | ferro (e cálcio) | Azul |
| H | 3968 | Cálcio | |
| K | 3934 | Cálcio | Violeta |
Estas linhas eram todas brilhantes, enquanto as linhas de Fraunhofer eram escuras. Kirchhoff queria confirmar que as linhas escuras D descobertas por Fraunhofer eram linhas de sódio. Para isto ele passou a luz do Sol através de uma chama de sódio, esperando que as linhas do sódio preenchessem as linhas escuras do Sol. Para sua surpresa, as linhas D ficavam mais fortes, mais escuras. Ele então substituiu o Sol por um sólido quente, que emitia um contínuo. A luz do sólido que passava pela chama apresentava as mesmas linhas escuras do Sol, na posição das linhas do sódio. Ele então concluiu que o Sol era um gás ou sólido quente, envolto por um gás mais frio. Estas camadas mais frias é que produziam as linhas escuras do Sol. Comparando o espectro, ele descobriu linhas de Mg, Ca, Cr, Co, Zi, Ba e Ni no Sol.
De suas experiências, Kirchhoff formulou as três leis empíricas da espectroscopia, para determinar a composição de uma mistura de elementos [Kirchhoff, Gustav (1860). Ueber die Fraunhoferschen Linien. Monatsberichte der Königliche Preussische Akademie der Wissenschaften zu Berlin: 662-665]:
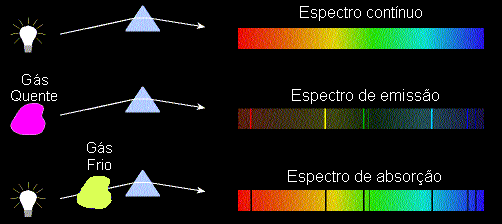
2) Um gás transparente produz um espectro de linhas brilhantes, de emissão. O número e a posição destas linhas depende dos elementos químicos presentes no gás.
3) Se um espectro contínuo passar por um gás à temperatura mais baixa, o gás frio causa a presença de linhas escuras, de absorção. O número e a posição destas linhas depende dos elementos químicos presentes no gás, na mesma posição das linhas de emissão daquele elemento químico.
Embora um átomo isolado só emita em determinados comprimentos de onda, muitos átomos comprimidos juntos num material emitem radiação em uma banda de linhas, já que têm velocidades diferentes e os comprimentos de onda se deslocam pelo efeito Doppler.
É importante notar que as linhas escuras não significam ausência de luz, somente o contraste de menos luz. O gás mais frio absorve mais radiação que emite e, portanto, gera linhas escuras. Se estiver em equilíbrio, isto é, nem aquecendo nem esfriando, um gás absorve a radiação vinda em sua direção e a re-emite em todas as direções, causando um decréscimo de fluxo na direção da fonte. Se não estiver em equilíbrio, o gás aquece.
A observação dos espectros estelares tomou impulso em 1860 com Giovanni Battista Donati (1826-1873) em Florença, e logo depois com Lewis Morris Rutherfurd (1816-1892) em Nova Iorque, George Biddel Airy (1801-1891) em Greenwich, William Huggins (1824-1910) em Londres, e Pietro Angelo Secchi (1818-1878), em Roma.
Em 1862, o astrônomo sueco Anders Jonas Ångström (1814-1874), aumentando a precisão de medida do comprimento de onda, identificou as linhas de hidrogênio no Sol. A identificação do elemento hidrogênio já havia sido feita em 1766 pelo físico e químico inglês Henry Cavendish (1731-1810).
Em 1868, o astrônomo inglês Sir Joseph Norman Lockyer (1836-1920) descobriu uma linha inexplicada na parte amarela (5875 Å) do espectro do Sol, que ele identificou como um novo elemento químico - hélio -, do grego helios, Sol, na cromosfera [Spectroscopic Observations of the Sun, 1868, Proceedings of the Royal Society of London, Volume 17, pp. 131-132]. Lockyer mais tarde fundou a revista Nature, e foi seu editor por 50 anos. Independentemente, o astrônomo francês Pierre-Jules-César Janssen (1824-1907) também identificou esta linha, no mesmo ano. Somente 27 anos mais tarde o elemento hélio foi descoberto na Terra, pelo químico escocês Sir William Ramsay (1852-1916) quando o espectro de um minério de urânio contendo hélio produziu uma linha na posição exata daquela encontrada por Lockyer no espectro do Sol. Hoje em dia sabemos que o hélio é o segundo elemento mais abundante no Universo. O primeiro é o hidrogênio. Ramsay recebeu o prêmio Nobel em química em 1904, pela descoberta dos gases nobres no ar, junto com John William Strutt, Lord Rayleigh (1842-1919), 3o Barão de Rayleigh, prêmio Nobel de física em 1904, pela descoberta do argônio. Rayleigh também descobriu o espalhamento Rayleigh, espalhamento por partículas muito menores que o comprimento de onda, que explica porque o céu é azul.
No início do século XX, os cientistas começaram a estabelecer as bases para a compreensão da formação dos espectros à medida que eles começaram a aprender mais sobre a estrutura dos átomos e a natureza da luz.

Isso gerou a suspeita de que as leis da mecânica clássica não se aplicavam totalmente a corpos microscópicos como os átomos e propiciou o surgimento da mecânica quântica.
Em 1900, o físico alemão Max Karl Ernest Ludwig Planck (1858-1947) desenvolveu o modelo da quantização da luz, segundo o qual a matéria emite luz em pacotes de energia, que ele denominou quanta.
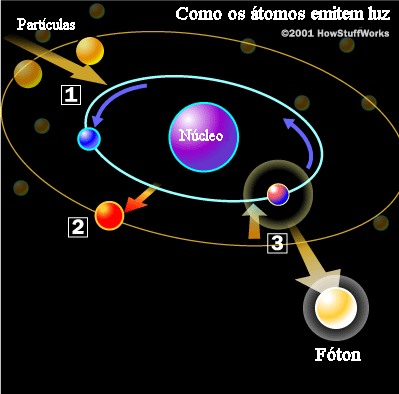
Albert Einstein (1879-1955), em 1905, estudando o efeito fotoelétrico, usou a idéia da quantização e assumiu que cada quantum de luz, ou fóton, tem uma energia E dada por:
onde h é a constante de Planck,
|


O físico francês Louis-Victor Pierre Raymond, Príncipe de Broglie (1892-1987), em sua tese de doutorado em 1924 [Recherches sur la théorie des quanta, Thesis (Université de Paris), 1924; L. de Broglie, Annales de Physique (Paris) 3, 22 (1925)], mostrou que o momentum de cada fóton, ou qualquer partícula, na dualidade onda-partícula, é dado por:
de Broglie também propôs que os elétrons de um átomo só podem ocupar níveis quantizados, o que mais tarde foi melhor entendido com a formulação da mecânica quântica pelo físico austríaco Erwin Rudolf Josef Alexander Schrödinger (1887-1961), publicada em 1926 (Quantisierung als Eigenwertproblem, no Annalen der Physik, 384 (4): 273-376), pela qual recebeu o prêmio Nobel de física em 1933.
de Broglie, seguindo o físico dinamarquês Niels Henrik David Bohr (1855-1962), prêmio Nobel de física em 1922, assumiu que as órbitas são quantizadas, isto é, que a órbita do elétron deveria conter um número inteiro de comprimentos de onda:
onde n=1,2,3,... só assume números inteiros. Estando nessas órbitas, os elétrons não emitem radiação.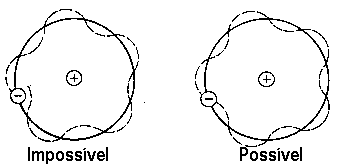
Pela lei de Coulomb [Charles Coulomb (1736-1806)], a força elétrica entre o próton nuclear e o elétron é dada por:
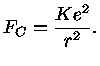
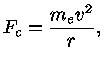
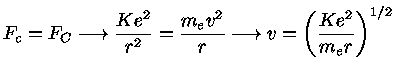 |
(1.3a) |
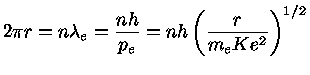
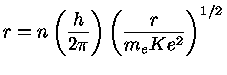
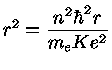
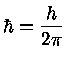
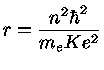 |
(1.5a) |
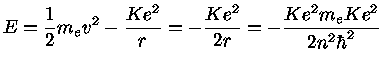
| 1 eV = 1,602 × 10-19 J |
| 1 eV = 1,602 × 10-12 ergs |
Por conservação de energia, quando um átomo passa de um nível de energia maior, n1 para outro de energia menor, n2, há emissão de um fóton com energia:
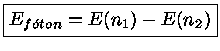
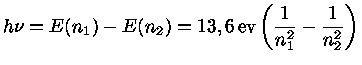 |
(1.8) |
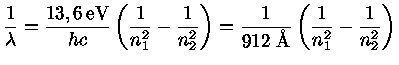
|
(1.9) |
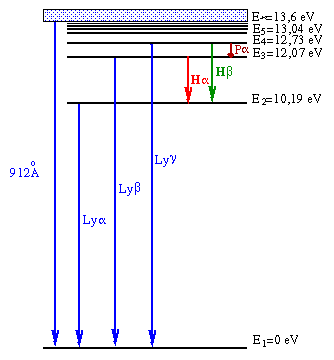
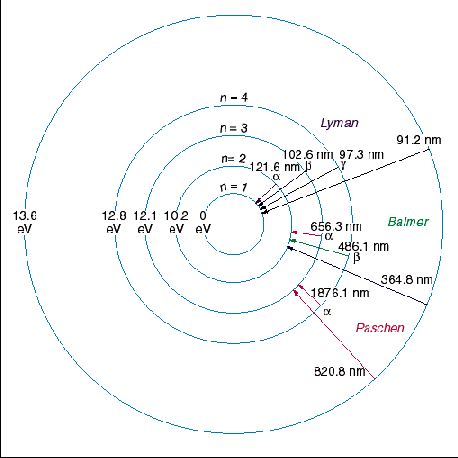
Portanto um átomo de hidrogênio só pode emitir fótons com certas energias para que seus elétrons passem de um nível n1 para um nível n2, assim como só podem absorver fótons destas energias para o processo inverso. Desta maneira, a detecção de uma linha espectral com este comprimento de onda, em emissão ou absorção, constitui evidência da presença do hidrogênio. de Broglie recebeu o prêmio Nobel de física em 1929.
Para átomos com mais de um elétron, é preciso ainda levar em conta o princípio da exclusão de Pauli [Wolfgang Pauli (1900-1958)], pois os elétrons são férmions e não podem ocupar o mesmo estado quântico, com o mesmo spin.
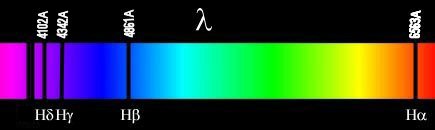
As principais linhas do hidrogênio são:
| Ly α 1216 Å | Ly β 1026 Å | Ly γ 973 Å | Ly ∞912 Å | Hα 6563 Å |
| Hβ 4861 Å | Hγ 4340 Å | Hδ 4102 Å | H7 3970 Å | H8 3889 Å |
| H9 3835 Å |
| H10 3798 Å |
| H11 3771 Å |
| H12 3750 Å |
| H∞ 3646 Å |
| P7 10049.8 Å |
| P8 9546.2 Å |
| P9 9229.7 Å |
| P10 9015.3 Å |
| P11 8862.89 Å |
| P12 8750.46 Å |
| P13 8665.02 Å |
| P14 8598.39 Å |
| Transição | λH(vácuo) | λH(ar) |
|---|---|---|
| Nome | (Å) | (Å) |
| Hα (n = 3 → n = 2) | 6564.70 | 6562.89 |
| Hβ (n = 4 → n = 2) | 4862.74 | 4861.38 |
| Hγ (n = 5 → n = 2) | 4341.73 | 4340.51 |
| Hδ (n = 6 → n = 2) | 4102.94 | 4101.78 |
| H7 | 3971.195 | 3970.07 |
| H8 | 3890.151 | 3889.05 |
| H9 | 3836.472 | 3835.39 |
| H10 | 3798.976 | |
| H11 | 3771.701 | |
| H12 | 3751.217 | |
| H13 | 3735.430 | |
| H14 | 3722.997 | |
| H15 | 3713.027 | |
| H16 | 3704.906 |
| 3189 Å | 3635 Å | 3706 Å | 3820 Å | 3889 Å | 3965 Å | 4026 Å | 4120 Å |
| 4143 Å | 4388 Å | 4471 Å | 4713 Å | 4922 Å | 5016 Å | 5048 Å | 5876 Å |
| 6678 Å | 7065 Å | 7281 Å |
Outras transições são matematicamente possíveis, mas são consideradas proibidas porque, nas condições terrestres, antes que um átomo possa irradiar por uma transição proibida, uma colisão com outro átomo ou molécula irá ocorrer e des-excitar o átomo colisionalmente. Como no meio interestelar os átomos estão muito mais distantes entre si do que na Terra, as colisões são muito raras e, portanto, as transições proibidas são importantes em nuvens de gás e no meio interestelar. Essas linhas foram explicadas, em 1927, pelo astrofísico e professor de física no Caltech, Ira Sprague Bowen (1898-1973).
Se os átomos emitem em linhas espectrais, de onde vem o espectro contínuo? Quando átomos interagem com outros, as linhas espectrais são alargadas, já que os átomos têm velocidades diferentes e os comprimentos de onda se deslocam pelo efeito Doppler. Quando um agregado de átomos interage fortemente, como em um sólido, líquido, ou gás opaco, todas as linhas são tão alargadas, que produzem um contínuo térmico.
Embora Fraunhofer, em 1823, tivesse observado que as estrelas tinham espectros de linhas escuras como o Sol, investigações mais completas dos espectros das estrelas foram feitas por Sir William Huggins (1824-1910) e pelo jesuíta Irmão Angelo Secchi (1818-1878) do observatório do Vaticano, que notaram que os espectros estelares não eram todos iguais; só alguns se pareciam com o do Sol. Em 1864 Sir William Huggins obteve o primeiro espectro de uma nebulosa e, depois de observar mais 70 até 1868, concluiu que as nebulosas apresentavam linhas brilhantes - de emissão -, Hα do hidrogênio e outras que só foram identificados em 1927 como as linhas proibidas do O II (3727 Å), O III (5007 e 4959 Å), e N II (6548 e 6584 Å). Em 1863, Secchi fez a primeira classificação dos espectros das estrelas, de acordo com as linhas escuras.
Note-se que até esta época a fotografia
ainda não era possível, por isso os espectros eram observados
visualmente.
A técnica fotográfica foi desenvolvida em
1839, pela parceria Joseph-Nicéphore Niépce (1765-1833)
e Louis-Jacques-Mandé Daguerre
(1787-1851) , e
já em 1842, o francês Edmond Becquerel (1820-1891),
e poucos meses depois o inglês John William Draper (1811-1882),
fotografaram o espectro do Sol.
Somente em 1872 Henry Draper (1837-1882),
filho de John William Draper,
obteve a primeira foto de um
espectro estelar, da estrela Vega.
A classificação espectral usada atualmente foi
desenvolvida no observatório de Harvard, nos Estados
Unidos, no início do século XX.
, e
já em 1842, o francês Edmond Becquerel (1820-1891),
e poucos meses depois o inglês John William Draper (1811-1882),
fotografaram o espectro do Sol.
Somente em 1872 Henry Draper (1837-1882),
filho de John William Draper,
obteve a primeira foto de um
espectro estelar, da estrela Vega.
A classificação espectral usada atualmente foi
desenvolvida no observatório de Harvard, nos Estados
Unidos, no início do século XX.
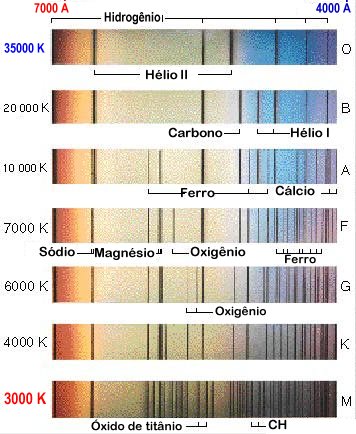
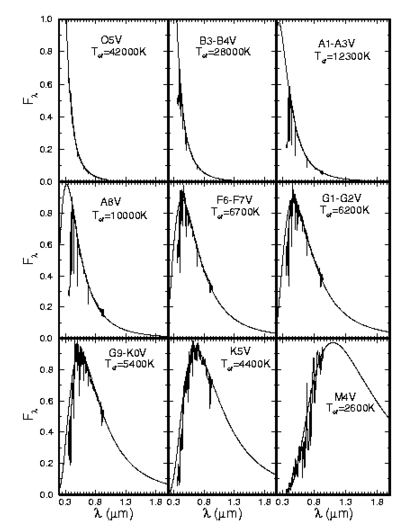
Atualmente as estrelas são classificadas em função decrescente da temperatura, como O B A F G K M:
| O | estrelas azuis, com Tef ≃ 20 000 a 35 000 K, apresentam linhas de He II - hélio uma vez ionizado - e ultravioleta forte. Exemplo: 10 Lac (V=4,88, O9 V) e Mintaka (δ Ori, uma das Três Marias, V=2,10, O9 II). |
| B | estrelas branco-azuladas , com Tef ≃ 15 000 K, com linhas de He I. Exemplos: Rigel (β Ori, V=0,12, B8 Ia) e Spica (α Vir, V=0,90, B1 V). |
| A | estrelas brancas, com Tef ≃ 10 000 K, com linhas de H forte. Exemplos: Sírius (α Can Maj, V=-1,46, A1 V) e Vega (α Lyr, V=0, A0 V). |
| F | estrelas branco-amareladas, com Tef ≃ 7 000 K, com linhas de metais observadas. Exemplos: Canopus (α Car, V=-0,72, F0 Ib) e Procyon (α Can Min, V=0,38, F5 IV). |
| G | estrelas amarelas, com Tef ≃ 5 000 K, como o Sol, com fortes linhas de metais e H fraco. Ca (H e K) fortes. Exemplos: Sol (G2 V) e Capela (α Aur, V=0,08, G1 II). |
| K | estrelas alaranjadas, com Tef ≃ 4 000 K, com linhas metálicas dominantes. Contínuo azul fraco. Exemplos: Aldebarã (α Tau, V=0,80, K5 III) e Arcturus (α Boo, V=-0,04, K2 III). |
| M | estrelas vermelhas, com Tef ≃ 3 000 K, com bandas moleculares (TiO) muito fortes. Exemplos: Betelgeuse (α Ori, V=0,50, M2 Ib) e Antares (α Sco, V=0,88, M1I b). |
| Linha | Largura (Å) | λ (Å) |
|---|---|---|
| H8 | 3 | 3889.0 |
| Ca II K | 6 | 3933.7 |
| Hε | 50 | 3970.0 |
| Sr II | 8 | 4077.0 |
| He I | 12 | 4026.2 |
| Hδ | 12 | 4101.8 |
| Ca I | 6 | 4226.7 |
| Banda G | 15 | 4305.0 |
| Hγ | 12 | 4340.5 |
| He I | 12 | 4471.7 |
| Ba II | 6 | 4554.0 |
| 12C | 256 | 4618.0 |
| Metal-1 | 442 | 4584.0 |
| 12C-13C | 36 | 4737.0 |
| Hβ | 12 | 4862.3 |
| C2 | 204 | 5052.0 |
| C2+Mg I | 238 | 5069.0 |
| MgH+Mg I+C2 | 270 | 5085.0 |
| Mg I + Fe II | 20 | 5175.0 |
| MgH+Mg I | 44 | 5198.0 |
| Cr I | 12 | 5206.0 |
| MgH | 20 | 5210.0 |
| Mg I | 12 | 5170.5 |
| Mg I | 24 | 5176.5 |
| Mg I | 12 | 5183.5 |
| Na I | 12 | 5892.9 |
| CaOH | 10 | 6235.0 |
| CaH1 | 10 | 6385.0 |
| Hα | 12 | 6562.8 |
| TiO1 | 5 | 6720.5 |
| CaH | 505 | 6788.0 |
| CaH2 | 32 | 6830.0 |
| CN | 26 | 6890.0 |
| CaH3 | 30 | 6975.0 |
| TiO2 | 5 | 7059.5 |
| TiO3 | 5 | 7094.5 |
| TiO4 | 5 | 7132.5 |
| TiO5 | 9 | 7130.5 |
| TiO | 333 | 7209.0 |
| O I tri | 30 | 7775.0 |
| K I | 34 | 7687.0 |
| K I | 95 | 7688.0 |
| Na I | 15 | 8187.5 |
| Ca II tri | 26 | 8498.0 |
| Paschen 17→3 | 13 | 8467.5 |
| Ca II tri | 16 | 8542.0 |
| Paschen 14→3 | 42 | 8598.0 |
| Ca II tri | 16 | 8662.1 |
| Paschen 12→3 | 42 | 8751.0 |
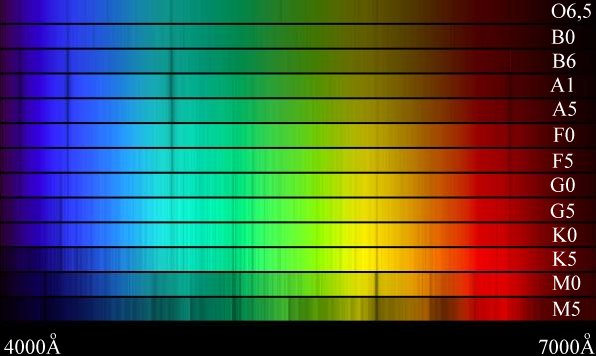

Cada tipo espectral se subdivide em 10 classes, sendo 0 a mais quente, dentro da classe e 9 a mais fria.
Nos anos 1990 foram descobertas estrelas mais frias que as M9, e adicionou-se as classes L, com temperaturas entre 2200K e 1400K e T, com temperaturas abaixo de 1400K (quando se forma o metano), e o mnemônico se tornou: Oh! Be A Fine Girl, Kiss Me Lovingly Tonight.
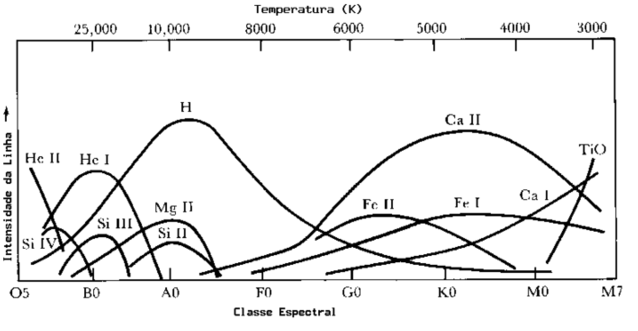
Cada linha escura no espectro de uma estrela está associada à presença de um elemento químico na atmosfera da estrela. Isso pode nos levar a pensar que as estrelas com linhas espectrais diferentes têm composição química diferente. No entanto, atualmente se sabe que a composição química das estrelas em geral é praticamente a mesma: aproximadamente 90% hidrogênio e aproximadamente 9% hélio (por número); outros elementos juntos contribuem entre 1% e 2% da composição e são chamados de metais. Portanto, o hidrogênio é de longe o elemento químico mais abundante nas estrelas e, ainda assim, as linhas do hidrogênio, embora fortes em algumas estrelas, são fracas em outras. Como isso se explica?
Na verdade, mais do que a composição química, é a temperatura que determina o espectro das estrelas. Consideremos uma linha de Balmer do hidrogênio. Essas linhas se originam em transições entre o segundo nível de energia do hidrogênio e qualquer outro nível acima dele: transições de nível para cima (n2 > 2) resultam em absorção, transições de nível para baixo (n2 = 2) resultam em emissão. Então, para uma estrela ter linhas de Balmer intensas, ela precisa ter muitos átomos de hidrogênio excitados ao nível n=2. Isso acontece em estrelas com temperatura efetiva em torno de 10 000 K (kT = 0,86 eV); para temperaturas muito mais baixas, como a do Sol por exemplo, o hidrogênio está no estado fundamental e poucas colisões podem acontecer com energia suficiente para excitar o hidrogênio. Já em estrelas com temperaturas muito mais altas, o hidrogênio está quase todo ionizado, devido às freqüentes colisões e, novamente, existem muito poucos átomos no nível n=2. Assim, as linhas de Balmer ficam fracas em estrelas muito quentes ou muito frias, apesar de o hidrogênio existir abundantemente em todas.

 Morgan &
Keenan
Morgan &
Keenan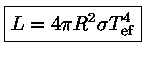

A classe de luminosidade é determinada pela largura das
linhas espectrais,
que dependem fortemente da gravidade superficial, diretamente
relacionada à luminosidade pelo raio.
Em detalhe, a largura da linha é dada pela convolução da largura da fenda do espectrógrafo, da pressão na atmosfera
da estrela, da rotação e campo magnético da estrela e do tamanho da imagem observada devido a atmosfera da Terra (seeing).
As massas das gigantes e anãs são
similares, mas o raio das gigantes é muito maior. Como a
aceleração gravitacional é dada por g:
![]()
ela é muito maior para uma anã do que para uma gigante.
Quanto maior a gravidade superficial, menor o raio, maior a pressão e, portanto, maior
o número de colisões entre as partículas na atmosfera da estrela.
As colisões perturbam os níveis de energia dos átomos, fazendo com
que eles fiquem mais próximos ou mais afastados entre si do que o normal.
Em conseqüência, os átomos perturbados podem absorver fótons de
energia e comprimento de onda levemente maior ou menor do que os
que os fótons absorvidos nas transições entre níveis não
perturbados. O efeito disso é que a linha de absorção fica alargada.
Portanto, para uma mesma temperatura, quanto menor a estrela, mais alargada
será a linha, pois a pressão será maior.
Atualmente usamos mais duas classes de luminosidades para luminosidades menores que as das anãs, as sd (sub-dwarf) sub-anãs (log g=5→6) e as D degeneradas, anãs brancas (log g=6→10). Andrew J. Pickles (1953-) publicou em 1998 um catálogo de fluxos esperados para os diversos tipos de estrelas, desde 1150 Å até 25 000 Å Publications of the Astronomical Society of the Pacific, Volume 110, Issue 749, pp. 863-878.
Um outro uso da espectroscopia é a derivação da velocidade radial, isto é, a velocidade do objeto na linha de visada, utilizando o efeito Doppler.
Em 1842 o físico austríaco Johann Christian Andreas Doppler (1803-1853) deduziu que, para um corpo luminoso se aproximando (ou se afastando) do observador, o comprimento de onda da luz diminui (aumenta), em relação àquele observado em laboratório. O comprimento de onda de uma fonte que está se movimentando com velocidade v em relação ao observador é deslocado por:
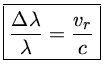
Em 1868 Sir William Huggins deduziu a velocidade radial de Sírius observando a pequena diferença no comprimento de onda da linha Hβ do hidrogênio. Mais tarde foram observadas variações nesta velocidade (veja Estrelas Binárias).
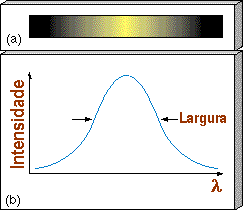
O perfil de uma linha representa a variação
da densidade de fluxo (intensidade) com o comprimento
de onda. A forma de uma linha espectral é chamada de
perfil da linha. A forma verdadeira da linha reflete
as propriedades da atmosfera da estrela: temperatura T, pressão P,
gravidade superficial g, densidade
![]() e velocidade das partículas v,
mas o perfil observado também é alargado pelo
instrumento de observação, incluindo a largura da fenda e a turbulência da atmosfera da Terra.
e velocidade das partículas v,
mas o perfil observado também é alargado pelo
instrumento de observação, incluindo a largura da fenda e a turbulência da atmosfera da Terra.
A composição química da atmosfera de uma estrela pode ser determinada pela razão das profundidades das linhas espectrais, que depende da temperatura e pressão.
O físico austríaco Ludwig Eduard Boltzmann
(1844-1906) derivou a relação
entre a densidade de átomos com um grau de excitação
(i+1) em relação à densidade de átomos com
um grau de excitação i:
![]()
onde Ei,i+1 = Ei+1-Ei é a diferença
de energia entre os estados final e inicial,
e gi é o peso estatístico do nível i,
isto é, o número de diferentes estados com a mesma
energia Ei; um nível com momentum angular J
tem gi = 2J+1.
Para o hidrogênio no nível n, gn = 2n2.
k=1,38 × 10-23J/K é a constante de Boltzmann.
Por exemplo, podemos calcular a fração de átomos de hidrogênio no nível n=2, em relação ao n=1 para temperaturas de T=10 000 K e 20 000 K. Como a diferença de energia entre os níveis n=2 e n=1 é de 10,19 eV, temos Ei,i+1=19,19 eV, g2=8 e g1=2. Pela Lei de Boltzmann, obtemos:
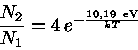
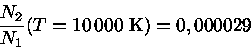
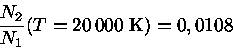
Podemos calcular o comprimento de onda de um fóton com energia equivalente a 10,19 eV notando que E=hν=hc/λ e, portanto, o comprimento de onda equivalente é de 1216 Å. Podemos também calcular o comprimento de onda de emissão máxima para T=10000 K, usando a Lei de Wien, obtendo λmax(T=10 000K)=2898,8 Å enquanto que λmax(T=20 000K)=1448,9 Å. Portanto é óbvio que uma estrela com Tef ≃ 20 000 K tem muito mais fótons com energia suficiente para excitar o elétron do átomo de hidrogênio ao nível n=2, explicando a grande diferença obtida.
| Nn/N1 | T=5040 K | 10 080 K | 20160 K |
|---|---|---|---|
| n=2 | 2,5×10-10 | 3,2×10-5 | 1,1×10-2 |
| n=3 | 6,9×10-12 | 8,1×10-6 | 8,3×10-3 |
| n=4 | 2,8×10-12 | 6,8×10-6 | 1,0×10-2 |
A intensidade de uma linha depende diretamente do número de átomos no estado de energia a partir do qual a transição ocorre. Precisamos então saber que fração de todos os átomos de um elemento estão naquele estado de energia, o que depende da temperatura T.
O bengali
Meghnad Saha (1893-1956) utilizou a
mecânica estatística
para derivar em 1921 o número de átomos
por unidade de volume em um grau de ionização
i+1 em relação ao grau
i, para um gás em equilíbrio termodinâmico local:
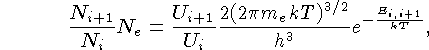
onde Ne é a densidade de elétrons
(número de elétrons por unidade de volume), N
é o número de átomos por unidade de volume,
Ui é a função
partição
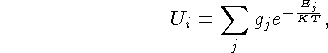
sendo Ej a energia acima do nível fundamental
do estado i,
k a constante de Boltzmann,
![]()
e me é a massa do elétron,
![]()
A dependência na densidade de elétrons, Ne,
se dá porque as
excitações e des-excitações ocorrem por
radiação e por colisão.
Quanto maior for a densidade de elétrons,
maior será a probabilidade de uma colisão.
Ambos processos dependem
da temperatura do meio, já que a energia média
das partículas é dada por:
![]()
Usando a lei dos gases ideais, válida para baixas densidades, Pe = Ne kT, podemos escrever:
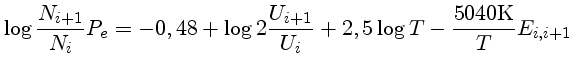
De acordo com Clabon Walter Allen (1904-1987), Astrophysical Quantities, 3rd Ed., p. 165, na fotosfera do Sol (profundidade ótica=1 em 5000 Å), Pe=57,5 dina/cm2 e Ne=6,5×1013 cm-3. Um valor representativo da fotosfera como um todo é Pe=3,4×104 dina/cm2 e Ne=3,8×1016 cm-3. Em uma situação em que o equilíbrio térmico ocorre, o número de átomos num estado não muda com o tempo. Cada excitação, em média, compensa uma desexcitação. Combinando-se as equações de Boltzmann e Saha, podemos calcular o número de átomos de hidrogênio em um nível de excitação n em relação ao número total de H=HI+HII: 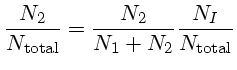
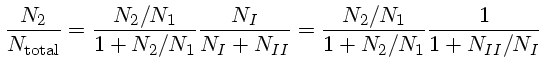
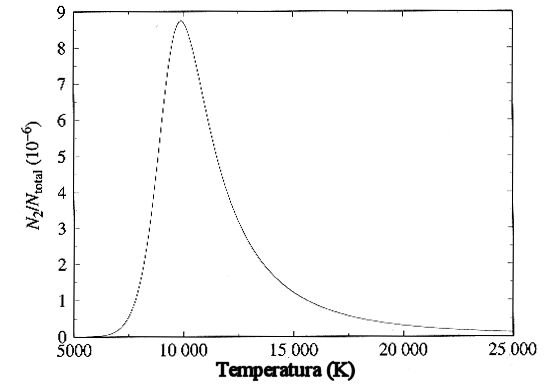
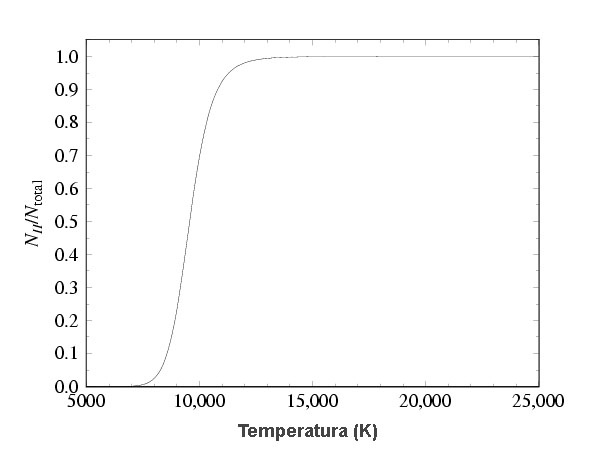
A aplicação das leis de Saha e Boltzmann é que nos permite interpretar os espectros das estrelas. Por exemplo, à Tef=5000 K a 7000 K, o cálcio deve estar na forma de CaII (uma vez ionizado). Estrelas com linhas fortes de CaII e fracas de CaI devem portanto ter temperaturas efetivas nesta faixa. Naturalmente isto depende também da densidade de elétrons, pela Lei de Saha. Para o hélio, UI=UIII=1 e UII=2, EI,II=24,58 eV e EII,III=54.41 eV. Para temperaturas abaixo de 10 000 K todo o hélio está neutro. Entre 10 000 K e 14 000 K varia de quase todo neutro para quase todo uma vez ionizado, permancendo uma vez ionizado até 22 000 K, acima da qual inicia a segunda ionização, que se completa em 30 000 K.
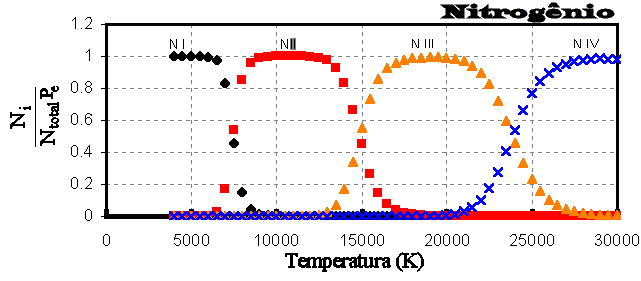 Mudanças de ionização do nitrogênio com a temperatura. 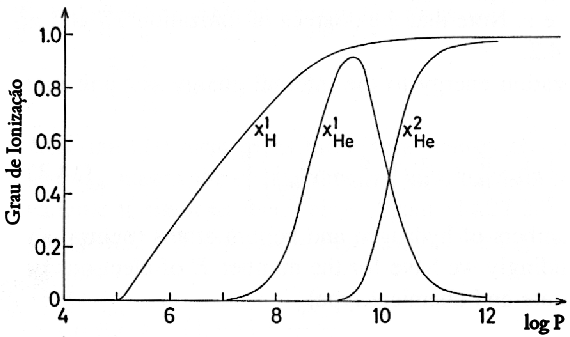 Ionização nas camadas externas do Sol. 
Ionização por pressão: a figura da esquerda mostra o potencial de um íon isolado e a da direita a interferência no potencial devido à proximidade de outro íon a uma distância a. Se a distância a for menor que o raio do átomo, 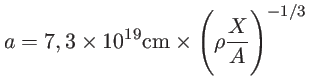
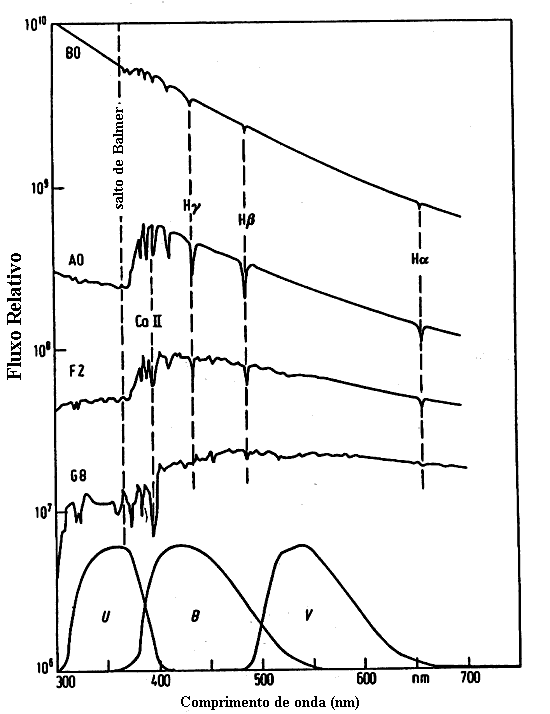 Curvas de transmissão dos filtros U, B e V, mostrando que linhas espectrais estão dentro dos filtros. 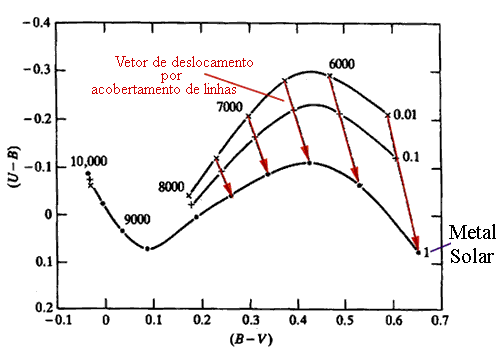 Efeito de acobertamento do espectro pelas linhas espectrais (line blanketing). Quando a metalicidade da estrela aumenta, as linhas de absorção causam uma transferência de energia para outros comprimentos de onda, mudando a cor da estrela. . . . . .
Uma lâmpada fluorescente típica é composta de um tubo de vidro recoberto com uma camada de fósforo, contendo vapor de mercúrio, e eletrodos localizados nas duas extremidades. Quando uma voltagem é aplicada, os eletrodos energizam o vapor de mercúrio, que emite radiação ultravioleta. O fósforo do revestimento do tubo absorve os fótons UV e emite luz visível pelo processo de fluorescência. Ao olharmos uma lâmpada fluorescente através de um espectroscópio, vemos um espectro de linhas brilhantes (emissão) superposto a um espectro contínuo. O espectro de linhas brilhantes é originado na emissão do vapor de mercúrio, portanto apresenta as linhas típicas deste elemento. O espectro contínuo é originado na emissão do revestimento (opaco) de fósforo.
A Digital Spectra Classification Atlas, R. O. Gray
© Modificada em 12 maio 2025 |